高考化学实验题类型汇总
时间:2023-04-20 11:34 来源:未知 作者:化学自习室 点击:次 所属专题: 实验综合题
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
以无机物质制备为载体的综合型实验
1.气体制备与性质实验装置的连接流程
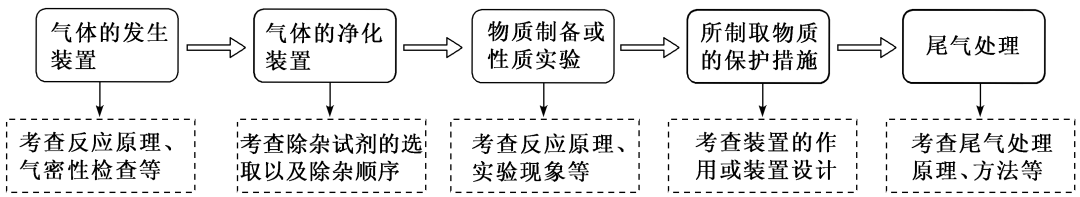
2.有气体参与的制备实验的注意事项
(1)操作顺序问题
与气体有关的实验操作顺序:装置选择与连接气密性检查装入固体药品加液体药品按程序实验拆卸仪器
(2)加热操作的要求
①使用可燃性气体(如H2、CO、CH4等)时,先用原料气赶走系统内的空气,再点燃酒精灯加热,以防止爆炸
②制备一些易与空气中的成分发生反应的物质(如H2还原CuO的实验),反应结束时,应先熄灭酒精灯,继续通原料气至试管冷却
(3)尾气处理的方法:有毒气体常采用溶液(或固体)吸收或将其点燃的方法,不能直接排放
(4)特殊实验装置
①制备在空气中易吸水、潮解以及水解的物质(如Al2S3、AlCl3等),往往在装置的末端再接一个干燥装置,以防止空气中水蒸气的进入
②用液体吸收气体,若气体溶解度较大,要加防倒吸装置
③若制备物质易被空气中氧气氧化,应加排空气装置
④制备的物质若为液态且易挥发时,应将收集装置置于冷水浴中
(5)冷凝回流
有些反应中,为减少易挥发液体反应物的损耗和充分利用原料,需在反应装置上加装冷凝回流装置(如长玻璃管、冷凝管等)
3.实验条件控制的操作与目的
(1)化学实验中温度控制的目的

(2)实验前排空的目的
①涉及可燃气体(H2、CO)的性质验证时,排空的目的是防止可燃气体与空气混合加热爆炸
②涉及与空气中O2、CO2作用的物质,排空的目的是防止反应物与空气中的O2、CO2反应
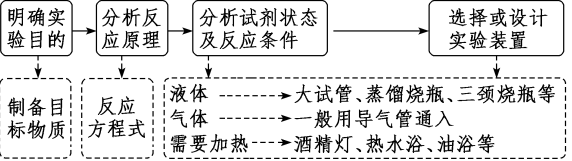
4.解无机制备类实验的思维流程
物质性质、实验原理的探究型综合实验
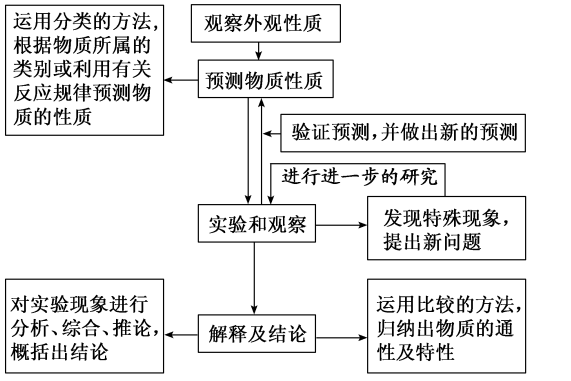
1.探究物质性质的基本方法和程序
2.性质、原理探究类实验的设计角度分析
(1)酸性强弱比较:可通过强酸制弱酸、对应盐溶液的碱性、同浓度溶液导电能力或pH等方法来比较

(2)金属性强弱比较:可通过与水或酸反应置换氢的能力、最高价氧化物对应水化物的碱性、置换反应、原电池的正负极、电解池中阴极阳离子的放电顺序等方法来比较
(3)非金属性强弱比较:可通过最高价氧化物对应水化物的酸性、气态氢化物的稳定性、与H2化合的难易程度、相互之间的置换、对应阴离子的还原性等方法来比较
(4)弱酸酸式盐的电离程度与水解程度比较:可通过测定溶液的酸碱性的方法来比较
(5)Ksp的大小比较

(6)一元酸、二元酸判断:可用NaOH溶液进行中和滴定测定消耗v(NaOH)来确定
(7)羟基的数目判断:可通过取一定量试剂与足量Na反应测定放出氢气的量来确定
(8)羧基的数目判断:可通过取一定量试剂与足量NaHCO3反应测定放出CO2的量来确定
3.解性质、原理探究类试题的思维流程
(1)第一步,明确实验目的,知道该实验要干什么
(2)第二步,逆推实验原理,依据目的联系所学知识,再结合提给信息设想探究方案
(3)第三步,回归题干寻找对应的情境信息与实验装置,迁移运用所学知识,锁定探究方案
(4)第四步,整体验证分析,定答案
物质成分或反应产物探究类综合实验
1.探究物质成分或反应产物的设计角度分析:通过化学反应原理猜测可能生成哪些物质,对这些物质一一的检验来推测出究竟含有哪些物质
(1)钢铁发生电化学腐蚀的规律探究:可以通过控制钢铁是否与空气接触、所接触的电解质溶液的酸碱度、钢铁在腐蚀过程中体系内的气压变化等设计实验,找出规律

根据物质性质,使被检验物质与加入的试剂作用,转变为某种已知物质,或产生某种特殊现象,从而确定该物质的存在(物质性质也是帮助检验的重要依据)。常见的特殊现象有:

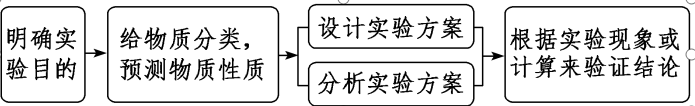
3.解物质成分或反应产物探究类实验题的思维流程
定量分析型综合实验
【方法与技巧】
1.定量测定中的相关计算
(1)常用的计算公式:n=m/(M),n=V/22.4(标况下、气体),n=cV(aq)
(2)常见的计算类型
①物质的质量分数(或纯度)=混合物的总质量/(该物质的质量)×100%
②产品的产率=产品的理论产量/(产品的实际产量)×100%
③物质的转化率=加入原料的总量/(参加反应的原料量)×100%
④物质组成的计算
2.定量测定的常用方法
(1)沉淀法:先将某种成分转化为沉淀,然后称量纯净、干燥的沉淀的质量,再进行相关计算
(2)测气体体积法:对于产生气体的反应,可以通过测定气体体积的方法测定样品纯度。体体积的测定既可通过测量气体排出的液体体积来确定(二者体积值相等),也可直接测量收集的气体体积
①直接测量法
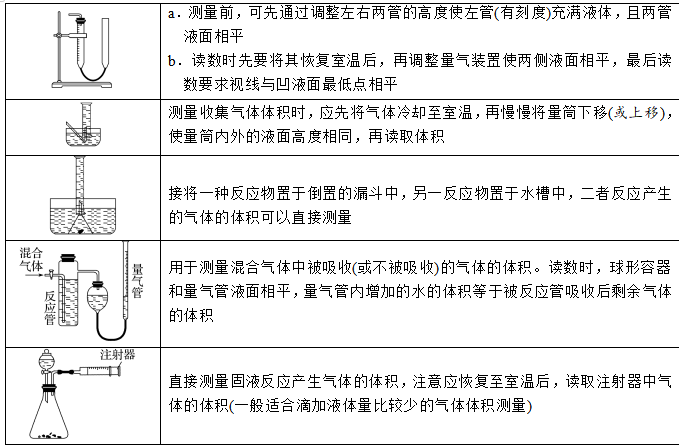
②间接测量法:通过测量气体排出的液体体积来确定气体体积
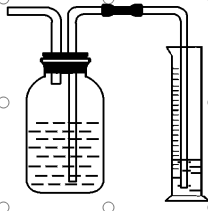
(3)测量气体质量法
①方法1:称反应装置在放出气体前后的质量减小值
②方法2:将生成的气体通入足量的吸收剂中,通过称量实验前后吸收剂的质量,求得所吸收气体的质量,然后进行相关计算
(4)滴定分析法:定量实验中的滴定方法包括酸碱中和滴定、沉淀滴定、氧化还原滴定等,主要是根据滴定过程中标准溶液的消耗量来计算待测溶液的浓度
①类型
A.连续滴定法:第一步滴定反应生成的产物,还可以继续参加第二步的滴定。根据第二步滴定的消耗量,可计算出第一步滴定的反应物的量
B.返滴定法:第一步用的滴定剂是过量的,第二步再用另一物质返滴定过量的物质。根据第一步加入的量减去第二步中过量的量,即可得出第一步所求物质的物质的量
C.碘量法测定:碘量法是氧化还原滴定中应用较为广泛的一种方法。I2可作氧化剂,能被Sn2+、H2S等还原剂还原;I-可作还原剂,能被IO3-、Cr2O7(2-)、MnO4-等氧化剂氧化。碘量法分为直接碘量法和间接碘量法,直接碘量法是用碘滴定液直接滴定还原性物质的方法,在滴定过程中,I2被还原为I-;间接碘量法(又称滴定碘法),它是利用I-的还原性与氧化性物质反应产生I2,遇淀粉溶液显蓝色,再加入Na2S2O3标准溶液与I2反应,滴定终点的现象为蓝色消失且半分钟内不变色,从而测出氧化性物质的含量。如:用间接碘量法测定混合气中ClO2的含量,有关的离子方程式为2ClO2+10I-+8H+===2Cl-+5I2+4H2O和I2+2S2O32-===2I-+S4O62-,得关系式2ClO2~5I2~10S2O32-,然后根据已知条件进行计算
②滴定实验中常用的计算方法——关系式法
关系式法常应用于一步反应或分多步进行的连续反应中,利用该法可以减少不必要的中间运算过程,避免计算错误,并能迅速准确地获得结果。一步反应可以直接找出反应物与目标产物的关系;在多步反应中,若第一步反应的产物是下一步反应的反应物,可以根据化学方程式,将该物质作为“中介”,找出已知物质和所求物质之间量的关系。利用这种方法解题的关键是建立已知物质和所求物质之间量的关系式
如:用Na2S2O3滴定法测水中溶氧量,经过如下三步反应:
①O2+2Mn(OH)2===2MnO(OH)2
②MnO(OH)2+2I-+4H+===Mn2++I2+3H2O
③2Na2S2O3+I2===Na2S4O6+2NaI
以分离提纯为主线的有机制备类综合实验
1.有机物制备常考的仪器、装置
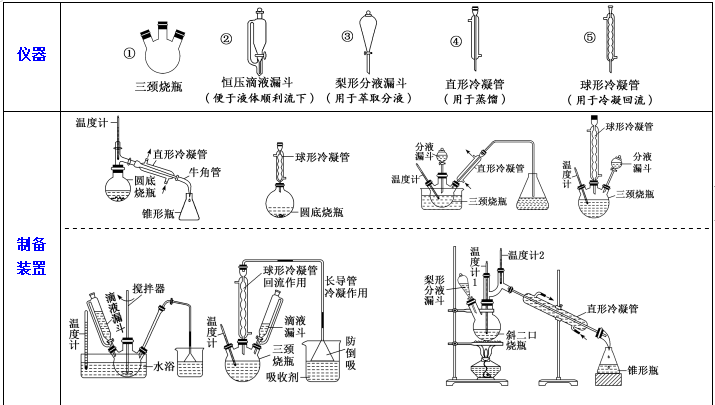
2.常见有机物的分离与提纯

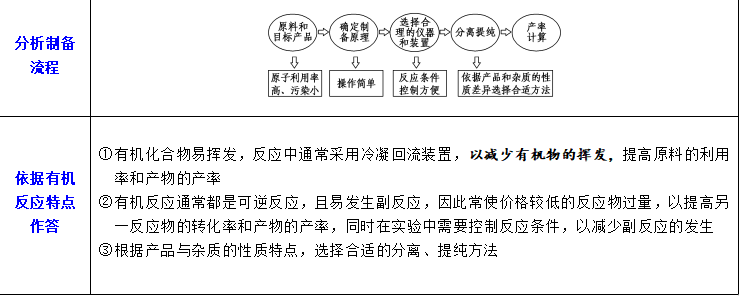
3.解有机物制备类实验的思维模型

- 全部评论(0)
