醇类的性质知识点总结
时间:2023-08-13 17:19 来源:未知 作者:化学自习室 点击:次 所属专题: 醇类
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、醇的结构
1、概念:
烃分子中饱和碳原子上的一个或几个氢原子被羟基取代的产物。
2、饱和一元醇通式:
CnH2n+1OH(n≥1)或CnH2n+2O(n≥1)
3、分类:
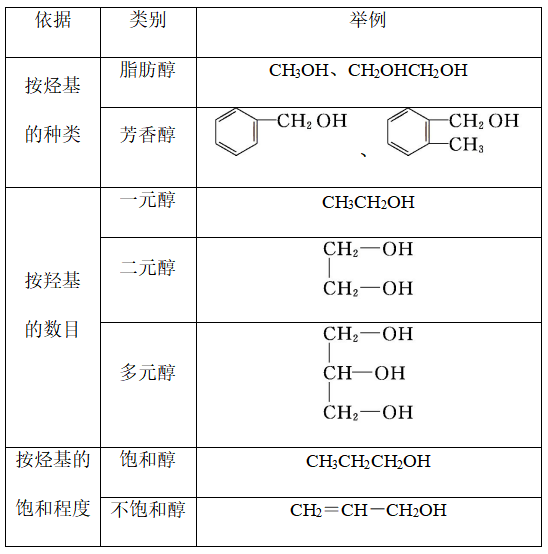
二、醇的物理性质
1、沸点
(1)直链饱和一元醇的沸点随着分子中碳原子数的递增而逐渐升高
(2)醇分子间存在氢键,所以相对分子质量相近的醇和烷烃相比,醇的沸点远高于烷烃
2、水溶性
(1)低级脂肪醇易溶于水
(2)饱和一元醇的溶解度随着分子中碳原子数的递增而逐渐减小
三、醇的化学性质
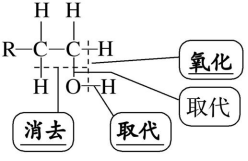
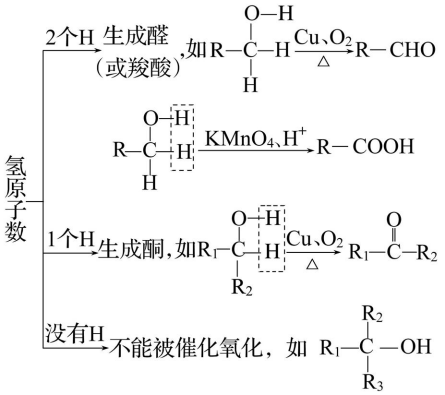
1、氧化反应
(1)催化氧化
①实验装置
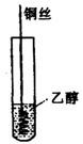
②实验步骤
向一支试管中加入3~5 mL 乙醇,取一根10~15 cm长的铜丝,下端绕城螺旋状,在酒精灯上灼烧至红热,插入乙醇中,反复几次。注意观察反应现象,小心闻试管中液体产生的气味。
③实验原理:

④说明
乙醇被弱氧化剂催化氧化的反应原理:乙醇分子中的氧氢键及与羟基相连的碳原子上的碳氢键断裂,脱去的两个氢原子与氧原子结合生成水,有机物中形成碳 氧双键。
氧双键。
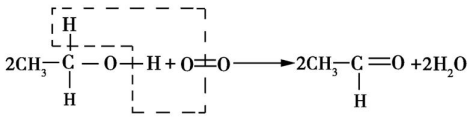
A.与羟基(—OH)相连的碳原子上有两个氢原子的醇,如CH3CH2OH、CH3CH2CH2OH等,被氧化生成醛。
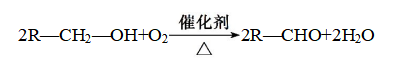
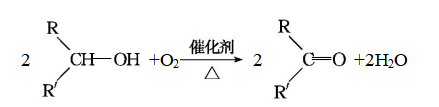
B.与羟基(—OH)相连的碳原子上有一个氢原子的醇,如![]() 、
、![]() 等,被氧化生成酮。
等,被氧化生成酮。
C.与羟基(—OH)相连的碳原子上没有氢原子的醇,不能被催化氧化,如
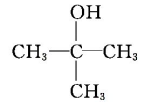 等。
等。
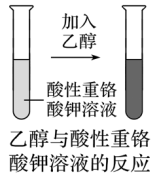
(2)与酸性重铬酸钾溶液反应
实验装置 |
|
实验步骤 | 在试管中加入少量酸性重铬酸钾溶液,然后滴加少量乙醇,充分振荡 |
实验现象 | 溶液由橙色变为绿色 |
实验结论 | 乙醇能被酸性重铬酸钾溶液氧化 |
因为乙醇可被重铬酸钾氧化,反应过程中溶液由橙黄色变成浅绿色。刚饮过酒的人呼出的气体中含有酒精蒸汽,因此利用本实验的反应原理,可以制成检测司机是否饮酒的手持装置,检查是否违法酒后驾车。
(3)乙醇的燃烧反应:
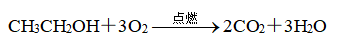
①现象:产生淡蓝色火焰,放出大量的热
②乙醇能作为绿色能源的原因:燃烧放出大量的热、燃烧产物无污染、可再生能源
【规律方法】醇的催化氧化规律
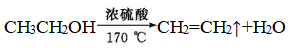
2、消去反应
(1)实验原理
(2)实验装置

(3)实验操作
①将浓硫酸和乙醇按体积比3∶1混合,冷却后加入长颈圆 底烧瓶中,并加入几片碎瓷片防止暴沸;
底烧瓶中,并加入几片碎瓷片防止暴沸;
②加热混合液,迅速升温并稳定在170 ℃,将生成的气体分别通入溴的四氯化碳溶液和高锰酸钾酸性溶液中。
(4)实验现象
溴的四氯化碳溶液和高锰酸钾酸性溶液褪色
(5)实验结论
乙醇在浓硫酸作用下,加热到170 ℃,发生消去反应,生成乙烯。
(6)乙醇的消去反应实验的注意事项
①体积比为3∶1的浓硫酸与乙醇混合液的配制:在烧杯中先加入5 mL 95%的乙醇,然后滴加15 mL 浓硫酸,边滴加边搅拌,冷却备用(相当于浓硫酸的稀释);在该反应中,浓硫酸是催化剂和脱水剂。
②加热混合液时,温度要迅速升高并稳定在170 ℃,因为温度在140 ℃时的主要产物是乙醚。
③因为参加反应的反应物都是液体,所以要向长颈圆底烧瓶中加入几片碎瓷片,避免液体受热时发生暴沸。
④温度计的水银球要置于混合液的中间位置。
⑤氢氧化钠溶液的作用是除去混在乙烯中的CO2、SO2等杂质,防止干扰乙烯与溴的四氯化碳溶液和高锰酸钾酸性溶液的反应。
3、取代反应
(1)乙醇的酯化反应
①实验装置
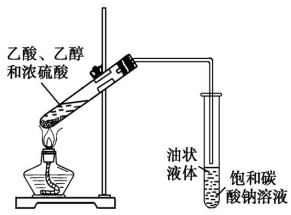
②反应条件及其意义
A.加热,主要目的是提高反应速率,其次是使生成的乙酸乙酯挥发而方便收集,使平衡向正反应方向移动,提高乙醇、乙酸的转化率。
B.浓硫酸一方面作催化剂,提高反应速率;另一方面作吸水剂,提高乙醇、乙酸的转化率。
C.饱和Na2CO3溶液的作用:挥发出的乙酸与Na2CO3反应生成易溶于水的盐,乙醇易溶于Na2CO3溶液,有利于乙酸乙酯与乙酸、乙醇的分离;乙酸乙酯在饱和Na2CO3溶液中的溶解度较小,与饱和Na2CO3溶液混合时易分层,可用分液法分离。
③实验现象:饱和碳酸钠溶液的液面上有无色透明的油状液体产生,并可闻到香味
④实验结论:在有浓硫酸存在、加热的条件下,乙酸与乙醇发生反应,生成无色、透明、微溶于水、有香味的油状液体
(2)酯化反应的特点
①所有的酯化反应,条件均为浓硫酸、加热。酯化反应为可逆反应,书写方程式时用“ ”。
”。
②利用自身酯化或相互酯化生成环酯的结构特点以确定有机物中羟基位置。
③在形成环酯时,酯基(![]() )中只有一个O参与成环。
)中只有一个O参与成环。
4酸与醇发生反应时,产物不一定生成酯。若是羧酸或者无机含氧酸与醇反应,产物是酯;若是无氧酸如氢卤酸与醇反应则生成卤代烃。
(3)酯化反应的类型
①一元羧酸和一元醇的酯化反应
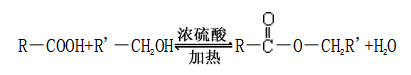
②一元羧酸与二元醇的酯化反应
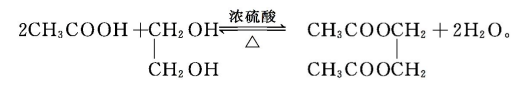
③二元酸与二元醇的酯化反应
A.反应生成普通酯

B.反应生成环酯

C.反应生成聚酯
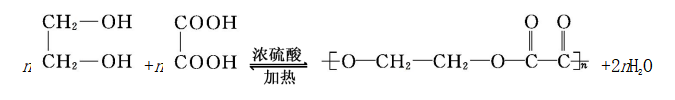
④无机含氧酸的酯化反应
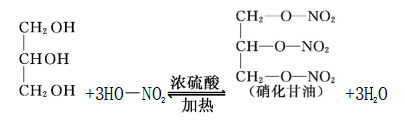
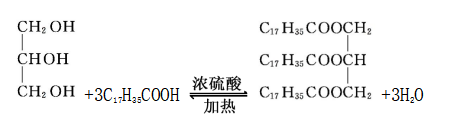
⑤高级脂肪酸与甘油的酯化反应
(2)与HX发生取代反应:分子中b键断裂,化学方程式为
![]()
(3)分子间脱水成醚:一分子中a键断裂,另一分子中b键断裂,化学方程式为
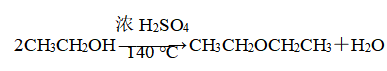
(4)与金属反应
乙醇与金属钠反应,生成乙醇钠,并放出氢气:
![]()
将钠投入煤油、乙醇、水中的实验现象比较:
| 实验项目 | 钠与煤油 | 钠与乙醇 | 钠与水 |
实验现象 | 钠沉于容器底部,不反应 | 钠沉于容器底部,有气泡缓慢逸出 | 钠熔成小球,浮在水面,四处游动,发出“嘶嘶”声,有气体产生,钠很快消失 |
通过上述实验现象可得出:
(1)密度:水>钠>煤油、乙醇。
(2)反应剧烈程度:钠与水反应比钠与乙醇反应剧烈。可推知水分子中的氢原子相对较活泼,而乙醇分子羟基中的氢原子相对不活泼。

- 全部评论(0)