酸碱中和滴定实验
时间:2023-08-14 10:00 来源:未知 作者:化学自习室 点击:次 所属专题: 中和滴定
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、概念和原理
1、概念:
依据中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法
2、原理:
在中和反应中,酸提供的H+与碱提供的OH-之间的物质的量相等
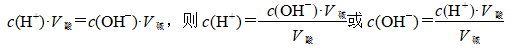
3、实验关键
①准确测定参加反应酸、碱的体积
②准确判断滴定终点
二、主要试剂
标准溶液、待测溶液、指示剂、蒸馏水
三、主要仪器及使用
1、仪器:
图(A)是酸式滴定管、图b是碱式滴定管、滴定管夹、铁架台、锥形瓶、烧杯、pH计
滴定管,铁架台,滴定管夹,锥形瓶,烧杯
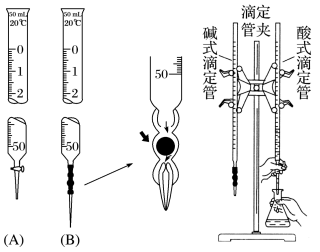
2、滴定管的认识
①构造:滴定管的管身是内径均匀、带有刻度的细长玻璃管,酸式滴定管的下端是玻璃活塞,碱式滴定管的下端是由橡皮管和玻璃球构成的阀
②滴定管的使用要求:酸式滴定管不能盛放碱液、水解呈碱性的溶液和氢氟酸,可以呈酸液、氧化性溶液和中性溶液,因为酸性和氧化性物质易腐蚀橡胶管;碱式滴定管不能盛放酸液和强氧化性溶液,可以呈碱液和中性溶液,因为碱性物质易腐蚀玻璃,致使活塞无法打开
③规格:滴定管的最小分度是0.1 mL,实验室中常用滴定管的规格有25 mL 和50 mL 两种
④精密度:取到小数点后两位,读数时应估读至0.01mL;如:24.00 mL、23.38 mL
⑤滴定管的读数方法:0刻度在上,从上往下读,最大量程有25 mL、50 mL (注意与量筒比较)
⑥用途:滴定管主要是用来精确地量取一定体积的液体
3、滴定管的使用方法
①检查仪器:使用滴定管前,首先要检查活塞是否漏水
检查滴定管是否漏水的方法:向滴定管内加水(对酸式滴定管,要先关闭活塞)至液面在“0”刻度线附近,用滴定管夹将滴定管固定在铁架台上,观察滴定管是否漏水。若不漏水,对酸式滴定管将活塞旋转180°,对碱式滴定管松动其阀门,放出少量液体,再次观察滴定管是否漏水,经两次检查都不漏水的滴定管是检漏合格的滴定管。只有不漏水的滴定管才能使用,若滴定管漏水,则不能使用
②润洗仪器:滴定管在加入酸、碱反应液之前,先用蒸馏水洗涤干净,然后分别用待装液润洗2~3次
润洗的方法:从滴定管上口加入3~5 mL 所要盛装的酸或碱,倾斜着转动滴定管,使液体润湿全部滴定管内壁。然后,一手控制活塞(轻轻转动酸式滴定管的活塞;或者轻轻挤压碱式滴定管中的玻璃球),将液体从滴定管下部放入预置的烧杯中
③加入反应液:分别将酸、碱反应液加入酸式、碱式滴定管中,使液面位于“0”刻度以上2~3 mL 处,并将滴定管垂直固定在滴定管夹上
④调节起始读数:在滴定管下放一烧杯,调节活塞或玻璃球,使滴定管尖嘴部分充满反应液,如果滴定管内部有气泡,应快速放液以赶出气泡,然后调节滴定管液面使其处于“0”刻度或“0”刻度以下的某一刻度。准确读取数值并记录

⑤放出反应液:根据实验需要从滴定管中逐滴放出一定量的反应液
四、实验操作
——以用盐酸标准液滴定NaOH溶液为例
(1)查漏:
使用前先检查滴定管活塞是否漏水
(2)洗涤
①锥形瓶:只能用蒸馏水洗涤,不能用待测溶液润洗
②滴定管洗涤:应先用自来水,再用蒸馏水,然后再用标准溶液(或待测溶液)润洗2~3次,以避免溶液被滴定管内壁上附着的蒸馏水稀释而导致浓度变小
③洗涤的原则:少量多次
④洗涤的标准:管内壁不挂水珠
(3)取液
①向润洗过的碱式滴定管中加入待测浓度的NaOH溶液,赶出气泡、调节液面至“0”刻度后,用碱式滴定管向锥形瓶中滴入25.00 mL 待测溶液,再向其中滴加2滴酚酞溶液
②向润洗过的酸式滴定管中加入标准盐酸,赶出气泡、调节液面至“0”刻度后准确记录读数为V1mL
(4)滴定:
在锥形瓶下垫一张白纸,左手控制滴定管的活塞,向锥形瓶中先快后慢地加入标盐酸(后面逐滴加入,接近终点时,改成滴加半滴酸),右手摇动锥形瓶,眼睛观察锥形瓶内溶液的颜色变化.
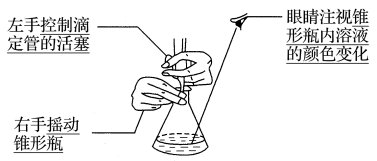
(5)读数:
当加入最后半滴标准盐酸,溶液由粉红色变为无色,且半分钟内不变色,停止滴定。平视滴定管中凹液面最低点,读取溶液体积为V2mL
(6)计算:
以(V2-V1)为消耗的标准盐酸的体积,取2~3次实验结果的平均值,依据
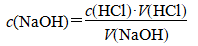
计算待测NaOH溶液的物质的量浓度
五、指示剂的选择
(1)中和滴定曲线:
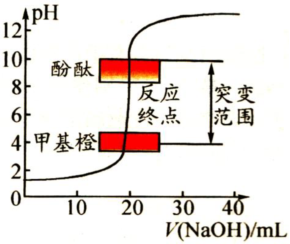
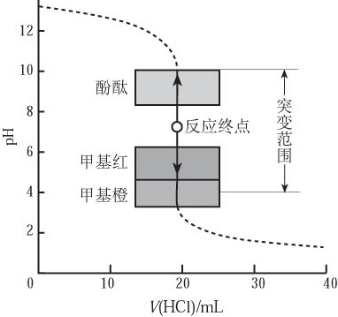
酸碱滴定曲线是以酸碱中和滴定过程中滴加酸(或碱)的量为横坐标,以溶液pH为纵坐标绘出的一条溶液pH随酸(或碱)的滴加量而变化的曲线。它描述了酸碱中和滴定过程中溶液pH的变化情况,其中酸碱滴定终点附近的pH突变情况(如上滴定曲线图),对于酸碱滴定中如何选择合适的酸碱指示剂具有重要意义。
(2)指示剂选择的依据:
由曲线可以看出,在酸、碱中和滴定过程中,溶液的pH在接近滴定终点时有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色发生明显变化,有利于确定滴定终点,所以即使酚酞、甲基橙的变色不在恰好中和的pH=7的点上,但体积差距很小,可以忽略不计
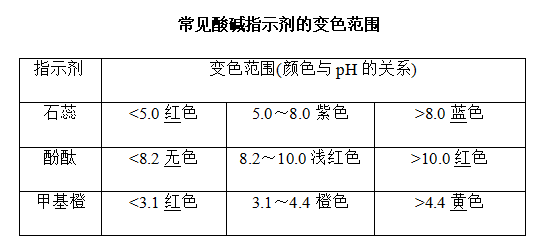
(3)酸碱指示剂法(只能测定溶液的pH范围)
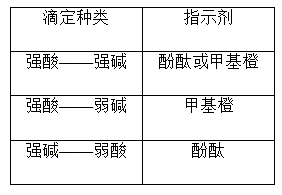
(4)中和滴定指示剂的选择
(5)滴定终点的判断
——以盐酸滴定未知浓度的NaOH溶液为例
①若用酚酞作指示剂,当滴入最后一滴盐酸时,溶液的颜色由粉红色突变为无色,且半分钟内不变色,说明达到滴定终点
②若用甲基橙作指示剂,当滴入最后一滴盐酸时,溶液的颜色由黄色变为红色,且半分钟内不变色,说明达到滴定终点。
六、误差分析
1、原理
CB=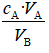 ,
,
VB是准确量取的待测液的体积,CA是标准溶液的浓度,它们均为定值,所以CB的大小取决于VA的大小,VA大则CB大,VA小则CB小。
2、误差分析
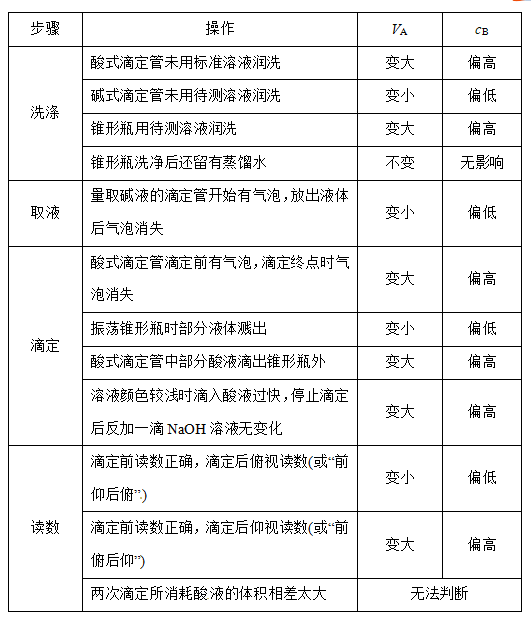
以标准酸溶液滴定未知浓度的碱溶液(酚酞作指示剂)为例,常见的因操作不当而引起的误差有:
七、酸碱中和滴定拓展应用
中和滴定操作不仅适用于酸碱中和反应,还可以迁移应用于氧化还原反应、NaOH和Na2CO3混合溶液与盐酸的反应及沉淀反应。
(1)氧化还原滴定法
①原理:以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质。
②实例
a.酸性KMnO4溶液滴定H2C2O4溶液
原理:2MnO4-+6H++5H2C2O4==10CO2↑+2Mn2++8H2O
指示剂:酸性KMnO4溶液本身呈紫色,不用另外选择指示剂,当滴入一滴酸性KMnO4溶液后,溶液由无色变为浅红色,且半分钟内不褪色,说明到达滴定终点。
b.Na2S2O3溶液滴定碘液
原理:2Na2S2O3+I2==Na2S4O6+2NaI
指示剂:用淀粉作指示剂,当滴入一滴Na2S2O3溶液后,溶液的蓝色褪去,且半分钟内不恢复原色,说明到达滴定终点。
(2)双指示剂滴定法
(以盐酸滴定NaOH和Na2CO3的混合溶液为例)
酚酞作指示剂:NaOH+HCl==NaCl+H2O;Na2CO3+H Cl==NaCl+NaHCO3
Cl==NaCl+NaHCO3
甲基橙作指示剂:NaHCO3+HCl==NaCl+CO2↑+H2O
(3)沉淀滴定法
(利用生成沉淀的反应)
应用最多的是银量法,即利用Ag+与卤素离子的反应来测定Cl−、Br−或I−的含量。

- 全部评论(0)
