焰色试验的原理是一个物理变化
时间:2023-11-14 16:31 来源:未知 作者:化学自习室 点击:次 所属专题: 焰色试验
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
焰色反应是一个非常有意思的现象,这个实验也非常好做,我们在家里就可以实操(找一个带有喷头的瓶子,装酒精的那种就可以,把酒精倒出来,冲洗干净,加入自来水,再加入一点食盐NaCl,然后喷到火焰上就能发现是黄色的亮光。火焰的话酒精灯可以提供,当然你家的燃气灶也可以提供火焰,但要注意一下燃气灶的使用安全)。
那么我们来讲一下焰色反应的微观原理,以及再确认一下焰色反应是物理变化还是化学变化。
现代化学原理认为,焰色反应是一种鉴别金属元素的方法。这种鉴别方法的原理是金属元素的原子核外电子吸收能量跃迁到高能轨道上,高能轨道上的电子回到低能态时,又以一定波长的光的形式释放出能量。不同的金属元素释放出不同波长的光。根据这一原理可以检验鉴别元素。
根据量子学说,原子按照其内部运动状态的不同,可以处于不同的定态,每一个定态会具有一定的能量。它主要包括原子体系内部运动的动能,核与电子间的相互作用能以及电子间的相互作用能。能量最低的状态叫做基态。能量高于基态叫做激发态,他们构成原子的各能级。高能量激发态可以跃迁到较低能态并发射出光子。反之较低能态可以吸收光子跃迁到较高激发态。发射或吸收光子的各频率构成发射光谱或吸收光谱。量子力学理论可以计算出原子能级跃迁时发射或吸收的光谱线位置,以及该光谱线的强度。
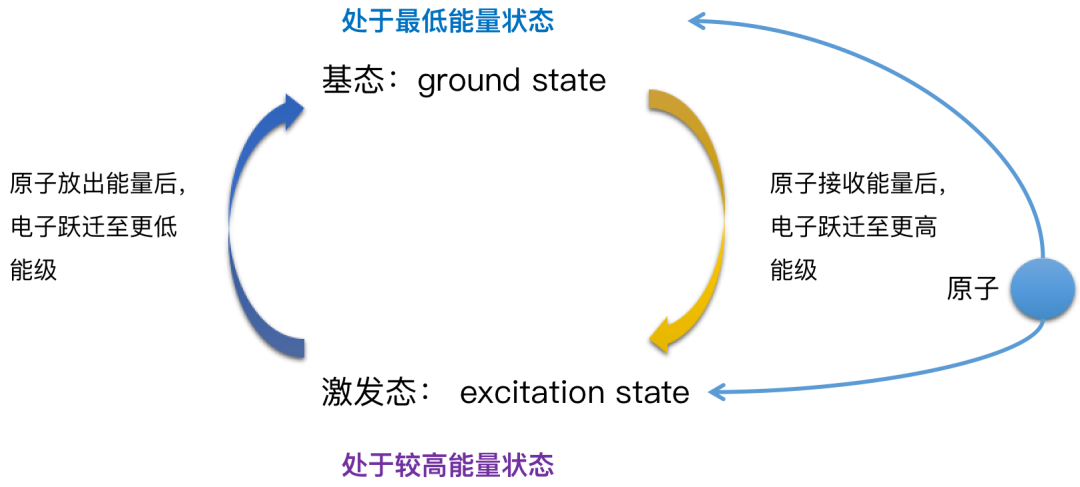
当金属元素的原子在火焰或一定电场中(可以给电子提供能量)时,核外运动的电子吸收一定的能量受到激发就会改变能级状态,原子一旦被激发就变得不稳定而趋于返回较低的能级状态,最终达到基态。在此过程中吸收或释放能量的方式之一,是以光子的形式发射光子。对应的光的波长与原子或离子的核外电子能级差有关系。
ΔE=hν
由于不同的微粒其核外电子具有的能量不同,电子跃迁时能量改变值不同,对应的光的波长不同。因此不同的金属或它们的化合物灼烧时呈现的颜色就不同。
例如,钠原子的核外电子在一些能级之间发生跃迁发出波长为589nm的光子,对应可见光区的黄光,所以钠的焰色反应呈黄色。
根据不同原子的能级图,可以计算出发生能级跃迁时发射光的波长。焰色反应是金属原子在火焰灼烧时发生能级跃迁而发射的具有特征颜色的光。
我们需要特别注意的,是焰色反应的本质是金属原子吸收能量后,由低能态向高能态跃迁,而高能态不稳定,当激发态原子从高能态向能态跃迁时就会发出不同(对应)波长的光。
所以从微观层面来讲,焰色反应更多像是一个物理变化。
最后,我们用大白话来总结一下,焰色反应就是一个发光现象,为什么会发光呢,那是因为金属原子的核外电子,被外界环境给予了更高的能量,然后这些电子就膨胀了,要单飞,要脱离因为原子核的束缚,想从原来的能量较低的轨道跑到更远的轨道,更远的轨道对应的电子能量也越高,但是吧,高处不胜寒,跑远了之后那边能量需求比较高,这些电子本身相当于磕药获取的能量终究不是自己的能量,它不稳定,最终还是得把磕药得来的能量全部或者部分还回去。能量还回来的时候,是以光子的形式,说在直白一点就是光。但是吧,能量不一样,光的颜色也不一样。这就得动用量子物理的公式了,到时候用它算一算光的波长λ,这个λ对应啥颜色的光,焰色反应就是什么颜色的光。
最后,中学阶段认为焰色反应是一个物理变化。

- 全部评论(0)
