“虚拟路径法”在化学学习中的妙用
时间:2023-10-30 08:27 来源:未知 作者:化学自习室 点击:次 所属专题: 等效法
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学学习过程中,我们经常碰到这样一类问题,如图一,由始态经途径I直接到终态,理解或解决起来很困难,而且这类问题往往与过程无关,只与始、终态有关。此时,我们不妨“迂回”一下,重新规划一下路径,按途径II进行,途径II分若干步,每一步是很容易理解或者操作起来很方便,从而降低分析、解决该问题的难度。我称这种方法为“虚拟路径法”,下面来看一下都有哪些场景可以尝试用“虚拟路径法”来解决。
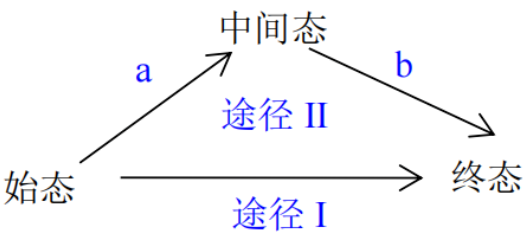
图一
应用场景一、某些反应热的测定
实验测定C(s)+½O2(g)=CO(g)的反应热没法直接实现,原因是碳在少量氧气中燃烧时,不可避免的会有一部分反应生成二氧化碳,这样就会导致测定的反应热数据不准确。通常的办法就是:先测定一定量的碳完全燃烧生成二氧化碳的反应热ΔH1,再测定等物质的量的一氧化碳完全燃烧时的反应热ΔH2,再根据盖斯定律计算出C(s)+½O2(g)=CO(g)的反应热ΔH=ΔH1-ΔH2。如下图:
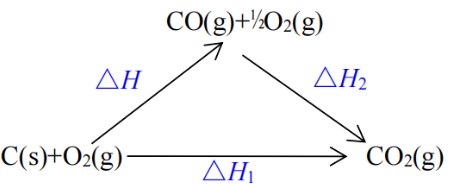
图二
这种测定方法,假定碳和氧气反应分成两步:(1)第一步全部生成CO(g);(2)第二步,生成的CO(g)和O2(g)完全反应,生成CO2(g)。实验过程中,并不直接用第一步的产物,而是找与第一步CO理论产量等量的纯净的CO做为第二步的反应物,从而间接的测出了C(s)+½O2(g)=CO(g)的反应热,并且避免了直接测定时因部分反应物生成CO2(g)导致数据不准的情况出现。很多反应热测定通常都是用这种方法。
应用场景二、一些化学方程式的理解和准确记忆
化学方程式的准确记忆,是很多学生学习化学的梦魇。死记硬背,时间没少花,方法不得当,效果不理想。比如说氯气和NaOH溶液的反应,是必修一的重要反应,生成物新,式子长,刚学时记不住。但学生刚刚经历氯气和水反应的探究,对氯气和水的反应印象深刻,而且对“酸、碱中和生成盐和水”这一反应规律也是耳熟能详,那么,就可以引导学生用“虚拟路径法”来分析氯气和NaOH溶液的反应:
(1)氯气先和NaOH溶液中的水反应,生成两种酸HCl和HClO ,即Cl2+H2O =HCl+HClO;
(2)生成的两种酸,再分别和NaOH发生中种反应,生成两种盐NaCl和NaClO,即HCl+NaOH=NaCl+H2O、HClO+NaOH=NaClO+H2O;
(3)由于前一步生成的HCl和HClO在后一步反应掉了,因此氯气和NaOH溶液的最终产物就是NaCl、NaClO和H2O,即Cl2+2NaOH=NaCl+NaClO+H2O。当然也可以用“叠加法”来处理这一步(如图三)。氯气和石灰乳制漂粉精的反应、SO2与碱的反应等也可以照方抓药。
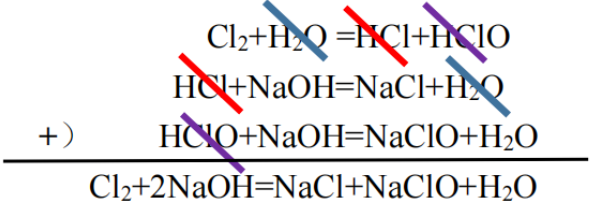
图三
应用场景三、化学平衡移动的分析
某温度下,在①、②、③三个完全相同的恒容容器中投入H2(g)和CO2(g),发生反应H2(g)+CO2(g)==H2O(g)+CO(g),起始浓度如下表所示。起始浓度/mol·L-1容器编号
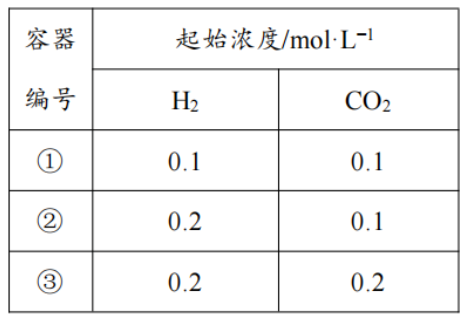
下列判断不正确的是
A.反应开始时,反应速率:③>①
B.CO2的平衡转化率:②>①
C.平衡时,③中c(CO2)是①中的2倍
D.H2的平衡转化率:③>①
根据“反应物浓度越大,反应速率越快”,不难判断反应开始时,反应速率:③>②>①。但是该例题中,由于三个容器的投料各不相同,直接比较三个容器的反应达到平衡时各物质的浓度及平衡转化率就有难度了,如果用“虚拟路径法”解决,问题就迎刃而解。容器②的投料分两次进行,先投入0.1mol·L−1H2和0.1mol·L−1CO2达到平衡,此时容器②中的平衡与容器①是等效的,也就是说两个容器中CO2的平衡转化率相等;再把0.1mol·L−1H2继续投入容器②,刚才建立的平衡正向移动,再次平衡后,CO2的平衡转化率增大,即CO2的平衡转化率:②>①。容器②分两次投料最终达到的平衡和一次投料所建立的平衡是等效的。
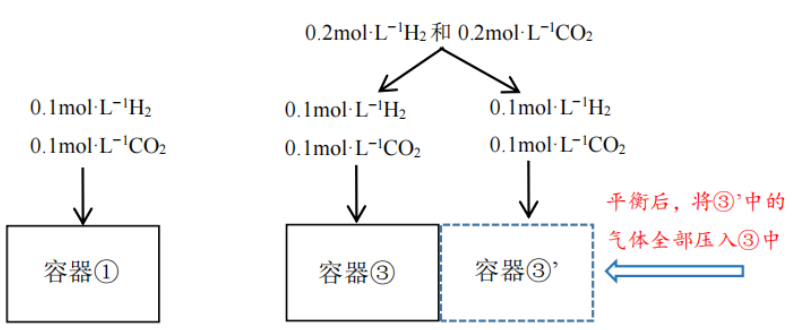
图四
如图四,再看容器③,各反应物的起始浓度是容器①的2倍,可以考虑把反应物均分成2份:其中一份直接投入容器③,想象紧挨着容器③还有一个和容器③一模一样的容器③’,将另一份反应物投入到容器③’中,分别建立平衡,则容器③、容器③’和容器①的平衡是等效的,此时三个容器中CO2的平衡浓度、H2的平衡转化率均相等。再加压将容器③’的平衡气体全部压入容器③,最终达到的平衡和容器③一次投料所建立的平衡是等效的。加压过程中气体总体积减半,由于该反应的∆V=0,平衡并不移动,所以容器③CO2的平衡浓度是容器①中的2倍,H2的平衡转化率与容器①相等。答案D也就呼之欲出了。
之前就有不少小伙伴让我讲讲“等效平衡”,迟迟没讲,估计要让大家失望了,因为以后我也不会讲。个人认为没必要讲,构建“等效平衡”应该是解决平衡问题的一种方法或思维模型,而不应该是知识点,总结那么多关于“等效平衡”的知识,除了增加学生负担,我实在想不出还有什么用处。
应用场景四、溶液的混合问题
【例题】将质量分数分别为10%和20%的硫酸溶液等体积混合,混合后溶液的浓度为( )
A.15% B.<15% C.>15% D.无法确定
设等体积的10%和20%的硫酸溶液的质量分别为m1g和m2g,由于硫酸的密度随质量分数增大而增大,因此m2>m1。我们从m2g 20%的硫酸溶液取出m1 g,先与m1g 10%的硫酸溶液混合,所得混合液的质量分数为15%,继续把剩余的(m2-m1)g 20%的硫酸溶液加入刚才所得混合液,最终所得混合液的浓度必然大于15%。用“虚拟路径法”是不是轻松搞定?

- 全部评论(0)
