怎样解原电池的问题?
时间:2019-05-07 21:57 来源: 作者:马文礼 点击: 次 所属专题: 原电池
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
电化学知识是以电解质溶液为载体,以氧化还原反应为核心,原电池的负极和电解池的阳极是氧化极,原电池的正极和电解池的阴极是还原极。因此,要从电子得失角度去分析有关的电极和电极反应,书写总化学方程式。例如,原电池的问题可从下列三类来分析。
第一类原电池,如铜锌原电池,其组成条件有三条:
(1) 两个活泼性不同的电极(金属与金属、金属与石墨碳棒、金属与难溶金属氧化物);
(2) 电解质溶液,至少要能与一个电极发生有电子转移的氧化还原反应,一般是置换反应;
(3) 两电极插入电解质溶液中且用导线连接。这种原电池中,较活泼的金属作负极,负极发生氧化反应,负极材料失去电子被氧化,形成阳离子进入溶液;较不活泼的金属作正极,正极上发生还原反应,溶液中原有的阳离子在正极上得到电子被还原,析出金属或氢气,正极材料不参与反应。电子总是从负极沿着导线流入正极。
因此,原电池现象是“负极下,正极上,电子就在中间转”。其特点是金属电极与电解质溶液之间存在自发的氧化还原反应。
例1.某原电池的总反应是Zn +Cu2+=Zn2++ Cu,该原电池的正确组成是( )
| A | B | C | D | |
| 正 极 | Zn | Cu | Zn | Cu |
| 负 极 | Cu | Zn | Cu | Zn |
| 电解质溶液 | CuCl2 | CuCl2 | ZnCl2 | ZnCl2 |
解析:从总反应可知,Zn失去电子,且Zn比Cu活泼,Zn应为负极。这是正规原电池,负极要能与电解质溶液发生置换反应,只能用CuCl2,故应选B。
第二类原电池的构成条件是:
(1) 两个活动性不同的电极;
(2) 任何电解质溶液( 酸、碱、盐皆可);
(3) 形成回路。 这类原电池的特点是电极与电解质溶液不发生置换反应,电解质溶液只起导电作用。其正极反应一般是吸氧腐蚀的电极反应式:O2+2H2O+4e-= 4OH-。
微电池(即若干微小的原电池)为不正规的原电池。合金或不纯的金属在潮湿空气中就能形成微电池。电化学腐蚀即微电池腐蚀,依然是原电池原理。一般原电池和微电池的区别在于前者中两个电极不直接接触,故前者电流是在导线中流动,而后者电流是在金属体内部流过。微电池腐蚀分为析氢腐蚀(发生在酸性较强的溶液里,正极上H+还原)和吸氧腐蚀 (发生在中性、碱性或极弱酸性溶液里,正极上是氧气被还原:O2+2H2O+4e- = 4OH-)。
例2. (89年广东高考题)把铁钉和碳棒用铜线联接后,浸入0.01 mol/L的食盐溶液中,可能发生的现象是( )
A. 碳棒上放出氯气
B. 碳棒近旁产生OH-
C. 碳棒上放出氧气
D. 铁钉上放出氢气
E. 铁钉被氧化
解析:由于Fe不与食盐溶液反应,属第二类原电池,溶液为中性,故发生吸氧腐蚀的反应。铁钉是负极,铁被氧化,Fe-2E =Fe2+;碳棒上:O2+2H2O+4E = 4OH-。应选B、E。
例3.有人设计以Pt和Zn为电极材料,埋入人体内作为某种心脏病人的心脏起博器的能源。它依靠人体内体液中含有一定浓度的溶解氧、H+和Zn2+进行工作。请写出两极反应的方程式。
正极 __________________________________,
负极 __________________________________。
解析:Pt、Zn和人体体液应构成第二类原电池,Zn为负极,其电极反应为:Zn-2E == Zn2+,Pt为正极,发生吸氧腐蚀的反应,O2+2H2O+4e-= 4OH-,但由于体液中有H+,产生的OH-将与H+反应生成水,正极反应即为上述两反应之和:
O2+2H2O+4e- == 4OH-
4OH-+4H+ == 4H2O
O2 +4H+ + 4e- == 2H2O
综上所述, 可得出如下结论:用导线连接或直接接触的任何两种活泼性不同的金属(其中一种可为碳棒),只要其中一种是比Pt、Au活泼的金属,与任何电解质溶液接触均可构成原电池。原电池中,较活泼的金属作为负极;有的电解质溶液未参加反应,只是增加了溶液的导电性。
原电池是一次电池,蓄电池是二次电池。蓄电池在充放周期内可反复充电,反复使用,是可逆电池。如果我们把可逆电池看成是第三类“原电池”,则它与前两类原电池的区别在于前者的正极材料不参与反应,而蓄电池的两极都要参与反应,是一种可逆过程,充电即为电解过程,放电即为原电池,以此分析其电极反应。
例4.(94年高考题)银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
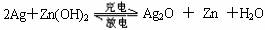 ,
,
在此电池放电时,负极上发生反应的物质是( )
A. Ag B. Zn(OH)2 C. Ag2O D. Zn
解析:放电为原电池的反应,即上述反应的逆过程,正、负极应是式子右边的物质。负极为Zn,电极反应为:Zn+2H2O-2e- = Zn(OH)2+2H+;正极为Ag2O,电极反应为:Ag2O+2H++2e- = 2Ag++H2O 。故应选D。

- 全部评论(0)
