价层电子对互斥理论概述
时间:2020-01-02 08:27 来源:未知 作者:陈功健 点击: 次 所属专题: 价层电子对互斥理论
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
现代化学的重要基础之一是分子(包括带电荷的离子)的立体结构。单写出路易斯结构式是不能得知分子或离子的立体结构的。分子的立体结构通常是指其σ—键骨架在空间的排布。现代实验手段可以测定一个具体的分子或离子的立体结构。例如,我们可以根据分子或离子的振动光谱(红外光谱或拉曼光谱)来确定分子或离子的振动模式,进而确定分子的立体结构:也可以通过X—衍射、电子衍射、中子衍射等技术测定结构。例如,实验测出,SO3分子是呈平面结构的,O—S—O的夹角等于120º,而 SO32-离子却是呈三角锥体,硫是锥项,三个氧原子是三个锥角,象一架撑开的照相用的三角架。又例如SO2的三个原子不在一条直线上,而CO2却是直线分子等等。早在1940年,Sidgwick和Powell就在总结测定结果的基础上提出了一种简单的理论(更确切地说,是一种模型),用以预测简单分子或离子的立体结构。这种理论后经Giliespie和Nyholm在50年代加以发展,并称之为VSEPR(Valence Shell Electron Pair Repulsion),即价层电子对互斥理论。我们不难学会用这种理论来预测和理解分子或离子的立体结构,并用来进一步确定分子或离子的结构。当然我们不应忘记,这一理论绝不可能代替实验测定,也不可能没有例外。不过统计表明,对于我们经常遇到的分子或离子,用这一理论来预言其结构,很少发现例外。作为一种不需要任何计算的简单模型,它应当说是很有价值的。
价层电子对互斥理论认为,在一个共价分子中,中心原子周围电子对排布的几何构型主要决定于中心原子的价电子层中电子对的数目。所谓价层电子对包括成键的σ电子对和孤电子对。价层电子对各自占据的位置倾向于彼此分离得尽可能地远些,这样电子对彼此之间的排斥力最小,整个分子最为稳定。这样也就决定了分子的空间结构。也正因此,我们才可以用价层电子对很方便地判断分子的空间结构。例如:甲烷分子(CH4),中心原子为碳原子,碳有4个价电子,4个氢原子各有一个电子,这样在中心原子周围有8个电子,4个电子对,所以这4个电子对互相排斥,为了使排斥力最小,分子最稳定,它们只能按正四面体的方式排布。这样就决定了CH4的正四面体结构。
利用VSEPR推断分子或离子的空间构型的具体步骤如下:
①确定中心原子A价层电子对数目。中心原子A的价电子数与配位体X提供共用的电子数之和的一半,就是中心原子A价层电子对的数目。例如BF3分子,B原子有3个价电子,三个F原子各提供一个电子,共6个电子,所以B原子价层电子对数为3。
计算时注意:
(ⅰ)氧族元素(ⅥA族)原子作为配位原子时,可认为不提供电子(如氧原子有6个价电子,作为配位原子时,可认为它从中心原子接受一对电子达到8电子结构),但作为中心原子时,认为它提供所有的6个价电子。
(ⅱ)如果讨论的是离子,则应加上或减去与离子电荷相应的电子数。如PO43-离子中P原子的价层电子数应加上3,而NH4+离子中N原子的价层电子数则应减去1。
(ⅲ)如果价层电子数出现奇数电子,可把这个单电子当作电子对看待。如NO2分子中N原子有 5个价电子,O原子不提供电子。因此中心原子N价层电子总数为5,当作3对电子看待。
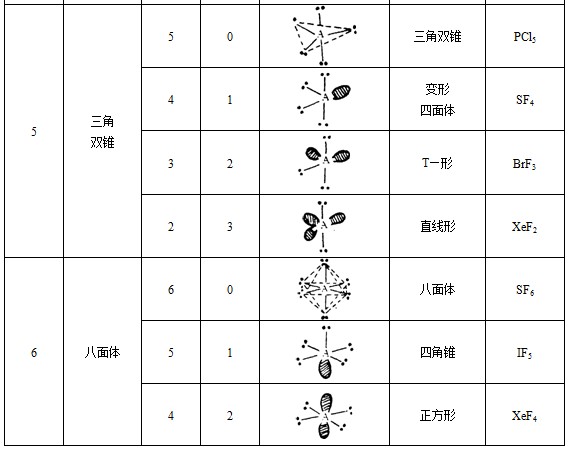
②确定价层电子对的空间构型。由于价层电子对之间的相互排斥作用,它们趋向于尽可能的相互远离。于是价层电子对的空间构型与价层电子对数目的关系如下表所示:

这样已知价层电子对的数目,就可及确定它们的空间构型。
③分子空间构型的确定。价层电子对有成键电子对和孤电子对之分。中心原子周围配位原子(或原子团)数,就是键对数,价层电子对的总数减去键对数,得孤对数。根据键对数和孤对敌,可以确定相应的较稳定的分子几何构型,如下表所示:
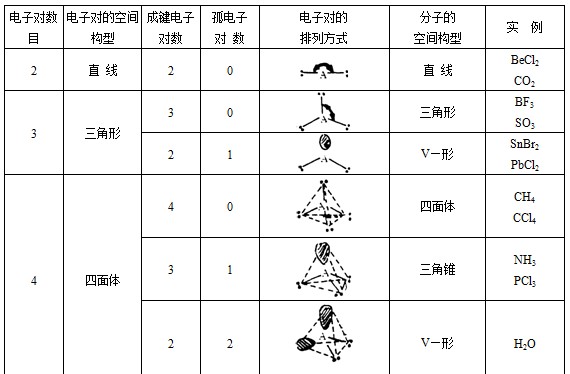
利用上表判断分子几何构型时应注意,如果在价层电对中出现孤电子对时,价层电子对空间构型还与下列斥力顺序有关:孤对—孤对>孤对—键对>键对—键对
因此,价层电子对空间构型为正三角形和正四面体时,孤电子对的存在会改变键对电子的分布方向。所以SnBr2的键角应小于120º,NH3、H2O分子的键角应小于109º28¹。
对于分子中有双键、叁键等多重键时,使用价层电子对理论判断其分子构型时,双键的两对电子和叁键的三对电子只能作为一对电子来处理。或者说在确定中心原子的价电子层电子对总数时,不包括π键电子。
使用价层电子对互斥理论我们可以判断在杂化理论中提到的所有只含一个中心原子的分子的结构,当然用这一理论也可以判断我们常遇到的所有单中心分子或离子的结构。

- 全部评论(0)
