为什么活化分子的碰撞不一定都发生有效碰撞
时间:2016-03-17 14:39 来源:未知 作者:陈博殷 点击:次 所属专题: 活化分子 有效碰撞
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
反应物分子之间发生有效碰撞,必须同时满足两个条件,一是反应物分子的能量必须达到某一临界数值,二是反应物分子必须按一定的方向互相碰撞。前者是能量因素,后者是空间因素。现以反应NO2+CO=NO+CO2为例来说明。
当NO2和CO分子彼此靠近时,它们分子中的价电子云就互相影响,结果,分子的键长和分子的形状都发生变化。NO2与CO分子在发生有效碰撞时,必须同时满足空间因素和能量因素两个条件。
(1)空间因素:NO2与CO分子只有在一定方向上碰撞,即N-O键和C-O键要在一条直线上发生碰撞,才能发生反应,如图2-4所示。
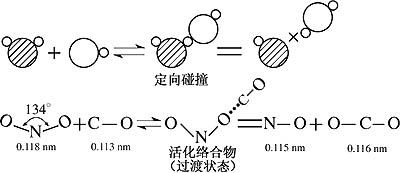
图 2-4NO2和CO的反应过程
很显然,当N-O与C-O在一条直线时,两个分子之间电子云相互影响最大,才有利于形成中间产物──活化络合物。
(2)能量因素:NO2与CO分子发生有效碰撞,必须克服它们价电子云之间的排斥作用,只有那些能量大的分子,当其平均能量具有或超过活化分子所具有的能量时,才能克服这种电子云间的排斥作用,形成一个处于活化状态的中间产物──活化络合物,原有的N-O键部分断裂,新的C…O键部分地形成,这种活化络合物既可以分解而成反应物NO2和CO,又可以形成生成物NO和CO2。图2-5反映了上述反应过程中能量的变化情况。
图2-5中,A点表示NO2+CO系统的平均能量,在此条件下,NO2与CO分子发生碰撞时并不发生反应。只有当NO2和CO分子的平均能量达到B处(或高于B处)时,碰撞才能形成活化络合物ONO…CO,而后发生反应。C是反应产物NO+CO2系统的平均能量。从图2-5还可以看到,E1是正反应的活化能,E2是逆反应的活化能。E2和E1之差是化学反应的热效应。正反应是放热反应,逆反应是吸热反应。
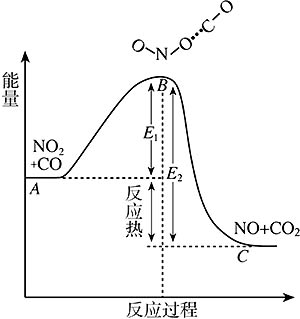
图 2-5NO2和CO反应过程中能量的变化
从以上分析可知,活化分子虽然具有反应所必需的能量,但如果两活化分子不在特定的相对位置发生碰撞仍不能发生反应。

- 全部评论(0)
