有关分子空间结构的判断方法
时间:2022-07-29 10:19 来源:未知 作者:爱莉 点击:次 所属专题: 分子空间结构判断
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
(一)价层电子对互斥模型(VSEPR models)
把分子分成两大类:一类是中心原子上的价电子都用于形成共价键。如CO2、CH2O、CH4等分子中的C原子。它们的立体结构可用中心原子周围的原子数来预测,概括如下:

另一类是中心原子上有孤对电子(未用于形成共价键的电子对)的分子。如H2O和NH3中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。因而H2O分子呈V形,NH3分子呈三角锥形。
说明:
1、理论模型:分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向于尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
2、运用价层电子对互斥模型可预测分子或离子的空间构型,但要注意判断其价层电子对数,对ABn型分子或离子,其价层电子对数的判断方法为:
![]()
3、在确定中心原子的价层电子对数时应注意如下规定:
①作为配体原子,卤素原子和氢原子提供一个电子,氧族元素的原子不提供电子;
②作为中心原子,卤素原子按提供7个电子计算,氧族元素的原子按提供6个电子计算;
③对于复杂离子,在计算价层电子对数时,还应加上负离子的电荷数或减去正离子的电荷数;
④计算电子对数时,若剩余1个电子,也当作1对电子处理,双键、叁键等多重键作为1对电子看待。
4、价电子之间的斥力:
①电子对之间的夹角越小,排斥力越大;
②由于成键电子对受两个原子核的吸引,所以电子云比较紧缩,而孤对电子只受到中心原子的吸引,电子云比较“肥大”,对邻近电子对的斥力较大,所以电子对之间的斥力大小顺序如下:孤电子对-孤电子对>孤电子对-成键电子>成键电子-成键电子
③由于三键、双键比单键包含的电子数多,所以其斥力大小顺序为:三键>双键>单键。
5、价层电子对互斥模型说明的是价层电子对形成的σ键的共用电子对和孤对电子对的空间构型,而分子的空间构型指的是形成σ键电子对的空间构型,不包括孤对电子。它包括两种类型:
①当中心原子无孤对电子时,两者的构型一致;
②当中心原子有孤对电子时,两者的构型不一致。如:
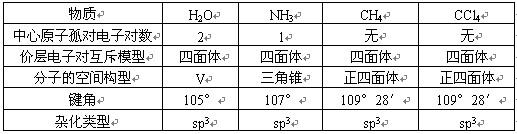
(二)杂化轨道理论:
杂化的概念:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫杂化轨道。一般情况下,我们所考虑的杂化是指s和p轨道之间的杂化。
根据参与杂化的s轨道与p轨道的数目,存在sp3、sp2、sp三种杂化,sp3 杂化轨道表示由一个s轨道与叁个p轨道杂化形成的,sp2 杂化轨道表示由一个s轨道与两个p轨道杂化形成的,sp杂化轨道表示由一个s轨道与一个p轨道杂化形成的。
说明:
1、对于非过渡元素,由于ns和np能级接近,往往采取sp型杂化
2、杂化轨道成键时,要满足化学键间最小排斥原则,键与键间排斥力的大小既决定于键的方向,又决定于杂化轨道间的夹角。由于键角越大化学键之间的排斥力越小。杂化轨道间的夹角与分子内的键角不一定相等,中心原子杂化类型相同时孤对电子对越多,键角越小,无孤对电子时,键角相同。三种杂化轨道的轨道形状,sp杂化夹角为180°的直线形杂化轨道,sp2 杂化轨道为120°的平面三角形,sp3杂化轨道为109°28′的正四面体构型;
3、杂化轨道与参与杂化的原子轨道数相同,但能量不同;
4、杂化轨道应尽量占据整个空间使它们之间的排斥力最小;
5、杂化轨道的类型与分子的空间构型有关
6、杂化类型的判断:
①公式:![]()
或:n=中心原子的孤对电子对数+配位原子总数
②根据n值判断杂化类型:
n=2时,sp杂化;n=3时,sp2杂化;n=4时,sp3杂化;
③当电荷数为正值时,公式中取“-”,当电荷数为负值时,公式中取“+”;当配位原子为氧原子或硫原子时,成键电子数为0。
④杂化轨道所形成的化学键一般为单键,即为σ键。
7、用短线表示共用电子对,和小黑点表示孤对电子的式子称为路易斯电子式,它既标出了成键电子对数,又标出了孤对电子对数,更有利于对物质空间结构的判断。
(三)配位键和配位化合物:
配位键:共用电子对由成键原子单方面提供所形成的共价键称为配位键
配位化合物:金属离子或原子与某些分子或离子以配位键结合而形成的化合物称为配位化合物。配位化合物的组成如下:
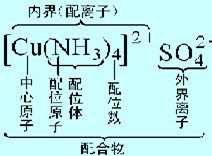
说明:
1、配位键是一种特殊类型的共价键,但其性质与结构与共价键完全相同;
2、形成配位键的条件是:中心原子有空轨道,配位体必须存在孤对电子;
3、配位化合物具有一定的稳定性。配合物中的配位键越强,配合物越稳定。当作为中心原子的金属离子相同时,配合物的稳定性与配位体的性质有关;
4、配合物形成时可能导致性质的改变:如颜色的改变:如Fe(SCN)3的形成;也可以导致溶解度发生变化,如:AgCl→[Ag(NH3)2]+,由不溶于水的沉淀,转变为易溶于水的物质。
5、配合物的命名
①关键在于配合物内界(即配离子)的命名。其命名顺序一般为:自左向右:配位体数(即配位体右下角的数字)-配位体名称-“合”字或“络”字-中心离子的名称-中心离子的化合价。如:
[Zn(NH3)2]SO4内界合称为二氨合锌(Ⅱ)
K3[Fe(CN)6]内界合称为:六氰合铁(Ⅲ)
②配合物可看作盐类,若内界为阳离子,则外界必为阴离子。若内界为阴离子,则外界必为阳离子。可按盐的命名方法命名:自右向左为:某酸某或某化某。
6、配合物易溶于水电离为内界配离子和外界离子,而内界的配体离子和分子通常不能电离。

- 全部评论(0)
