氢氧化钠在中学化学实验中的作用
时间:2012-03-05 17:00 来源:未知 作者:赵胜 点击:次 所属专题: 药品应用
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、物质的制备
(1)用浓氨水和氢氧化钠固体混合可以快速制取氨气;
(2)常用来制备一些难溶性碱,如:
MgCl2+ NaOH ===Mg(OH)2↓+ 2NaCl,FeCl3+ NaOH ===Fe(OH)3↓+ 3NaCl
二、物质的吸收
(1)氢氧化钠易从空气中吸收水分以及CO2等酸性气体,故在实验室中常做干燥剂,吸收实验室产生的SO2、Cl2等有毒残余气体,故其本身应密闭保存。
CO2+ 2NaOH===Na2CO3+ H2O,SO2+ 2NaOH ===Na2SO3+ H2O
(2)实验室制取氯气时多余的氯气用氢氧化钠吸收:
Cl2+ 2NaOH ===NaCl + NaClO + H2O
三、物质的性质证明
(1)证明Al、Si单质都能与强碱溶液发生反应生成氢气:
2Al + 2NaOH + 2H2O===2NaAlO2+ 3H2↑,Si + 2NaOH + H2O ===Na2SiO3+ 2H2↑,
(2)证明Al2O3、Al(OH)3是两性氧化物和两性氢氧化物。用Al2O3、Al(OH)3分别于强酸和强碱反应,其中分别与强碱反应的化学方程式为:
Al2O3+ 2NaOH ===2NaAlO2+ H2O,Al(OH)3+ NaOH ===2NaAlO2+ 2H2O,
(3)证明铵盐都能与碱反应,铵盐与碱共热有氨气产生。
(4)证明苯酚的酸性,在苯酚与水形成的乳浊液中加入氢氧化钠溶液震荡,溶液澄清。
C6H5OH + NaOH ![]() C6H5ONa + H2O
C6H5ONa + H2O
四、物质的鉴别
(1)鉴别NH4+:NH4++ OH-![]() NH3↑+ H2O,放出无色有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变蓝。
NH3↑+ H2O,放出无色有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变蓝。
(2)鉴别Al3+:Al3+ + 3OH-=== Al(OH)3↓,,加入适量的NaOH产生白色胶状沉淀,当NaOH过量时沉淀溶解,Al(OH)3+ OH-=== AlO2-+ H2O,加入氨水沉淀不溶解。
(3)鉴别Fe2+:Fe2+ + 2OH-=== Fe(OH)2↓,4Fe(OH)2+ O2+ 2H2O ===4Fe(OH)3。现象为产生白色絮状沉淀,立即转变为灰绿色,最终变成红褐色。
(4)鉴别Fe3+:Fe3+ + 3OH-=== Fe(OH)3↓,产生红褐色沉淀。
(5)淀粉水解产物的检验:在淀粉溶液中先加稀硫酸(催化剂)微热后,再加NaOH溶液中和到溶液显碱性后加银氨溶液或新制Cu(OH)2悬浊液检验。
【例题1】通过实验来验证淀粉水解可生成还原性的糖,实验包括下列一些操作过程,这些操作过程的正确顺序是
①取少量淀粉加水配成溶液 ②加热煮沸 ③加入碱液使溶液显碱性 ④加入新制的Cu(OH)2悬浊液⑤加入几滴稀H2SO4⑥再加热
A. ①②⑤⑥④③ B. ①⑤②④⑥③ C. ①⑤②③④⑥ D. ①⑥④⑤③②
解析:淀粉在无机酸的催化作用下,加热可发生水解反应而产生葡萄糖。要检验是否有葡萄糖的生成,应先加碱中和催化剂无机酸使之显碱性,然后再加入新制氢氧化铜悬浊液或银氨溶液,加热,观察有无红色沉淀或银镜出现。
答案:C
点拨:用碘水检验淀粉时,不能在碱性条件下进行,否则因发生
I2+ 2OH- ===IO-+ I-+ H2O而使实验不能成功;用银氨溶液或新制Cu(OH)2悬浊液检验水解产物葡萄糖时,必须在碱性条件下进行,因此必须预先用NaOH溶液将水解液中的催化剂H2SO4中和,并将溶液转化为碱性溶液。
【例题2】含8.0 gNaOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是
A.Na2S B.NaHS CNa2S和NaHS. D.NaOH和NaHS
解析:本题主要考查H2S的性质及讨论型计算题的解题方法,由于不能确定H2S是否过量,因此需要讨论以下几种情况:由于n(NaOH)= =0.2 mol,若NaOH全部转化为Na2S时,m(Na2S) = ×0.2 mol×78 g·mol-1 =7.8 g,若NaOH全部转化成NaHS时,
m(NaH) =0.2 mol×56 g·mol-1 =11.2 g。因为NaOH的质量为8.0g,而题中得无水物7.9g,7.8g<7.9g<8.0g,7.8g<7.9g<11.2 g,故该无水物可能为NaOH和Na2S的混合物,也可能为Na2S与NaHS的混合物,故本题答案为A。
答案:A
点拨:本题还可以用图像法(数轴法)解答,数形结合也是解题的有效方法。分析如下:
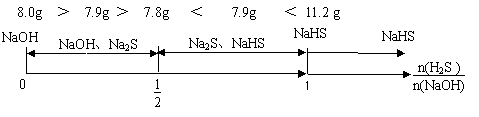

- 全部评论(0)
