原子半径的种类
时间:2016-03-08 10:53 来源:未知 作者:郝凯军 点击:次 所属专题: 半径分类
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
根据原子的不同键合形式表现的不同“大小”,有三种原子半径。
(1)金属半径 它是金属的原子半径,就是金属晶体中两相邻金属原子的核间距的半数值。很明显,它跟金属原子的堆积方式或配位数有关。一般说,配位数高,半径显得大。常见表中所列数据是折合成配位数为12的金属原子半径。金属原子半径可以用X射线衍射法测得金属晶体的晶胞参数,再结合它的点阵型式计算得到。
(2)共价半径 它指两个相同原子以共价单键结合时核间距的半数值。共价半径近似地满足加和规则,即任一共价键长约为两原子半径之和。
(3)范德华半径 它指在分子型晶体中,不属于同一分子的两个最接近的相同原子在非键合状况下,它们核间距的一半。例如,稀有气体的原子半径就是范德华半径。
同一种非金属,它的共价半径和它的范德华半径数值是不同的。例如在CdCl2晶体里,测得在不同的“分子”(实际是层状的大分子)里Cl与Cl间的核间距为dCl-Cl =3.76×10-10 m,取其值的一半定为氯原子的范氏半径①,即:
![]()
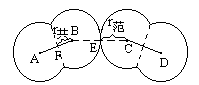
图 氯原子的共价半径与范氏半径
对非金属元素,r范>r共,从图示可以清楚地看出这一关系。图示表示出2个Cl2分子,在同一个Cl2分子里,2个Cl原子核间距的一半BF是共价半径(r共);在不同的2个Cl2分子间,2个Cl原子的核间距的一半CE是范氏半径(r范)。显而易见,r范>r共。
稀有气体在极低的温度下形成单原子分子的分子晶体。在这种晶体里,2个原子核的核间距的一半,就是稀有气体原子的范氏半径。下面列出非金属元素和稀有气体的范氏半径。
非金属元素和稀有气体的范氏半径r范(单位:10-10 m)
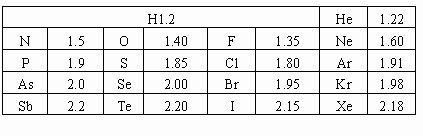
从上表可以看出,r范也有一定的规律性:在同一周期中,从左到右逐渐减小;在同一族中,从上到下逐渐增大。
在一般的资料里,金属元素有金属半径和共价半径的数据,非金属元素则有共价半径和范氏半径的数据,稀有气体只有范氏半径的数据。课本表里原子半径数据除稀有气体元素外,均为共价半径。

- 全部评论(0)
