分子结构规律——最大对称原理
时间:2022-12-08 16:45 来源:未知 作者:黄惠 点击:次 所属专题: 分子空间结构判断
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化合物中的中心原子周围的电子对之间总是尽可能最大角度地对称分布,因为共用电子之间的角度越大,对称性越高,它们之间的同性排斥力就必然越小,这样分子就必然越稳定。这个规律不妨叫做最大对称原理。
只有当中心原子周围的电子对(或共价键)相同时,它们才可能最大角度地对称分布。而凡是具有这种最大角度对称分布的分子必定是非极性分子。相反转来,凡是化合物的非极性分子中的中心原子周围的电子对(或共价键)都具有这种“最大角度的对称分布”。如CO2、SO3、CH4、CCl4等均具有这种分布。
根据最大对称原理可知:
化合物的非极性分子都具有对称的几何结构。
对于ABx型非极性分子来说,有下列几种结构
①当x=2时,AB2分子为直线型对称分子。如:CO2、CS2等。O=C=O、S=C=S;
②当x=3时,AB3型分子呈正三角形(即等边三角形)如:SO3等。
![]()
③当x=4时,AB4型分子呈正四面体结构。如:CH4、CCl4等。
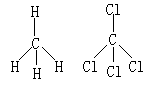
④当x=5时,AB5型分子呈正六面体结构。如图(1)PCl5等。呈三角双锥结构。
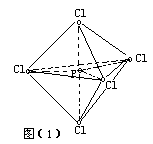
⑤当x=6时,AB6型分子则呈正八面体结构。如图(2)SF6等。
在这些化合物的非极性分子中,中心原子都是处于整个分子结构的对称中心(或重心)。
与上述相反,当中心原子周围的电子对不相同时,就不可能最大距离地对称分布,这样,分子中的电荷分布就不可能均匀对称,因此,这种分子就不可能是非极性分子,而只能是极性分子。如:CH3Cl中C原子周围的电子对就不相同,其中有三对是C![]() H电子对,有一对是C
H电子对,有一对是C![]() Cl电子对,所以CH3Cl分子中的四个共价键就不可能最大距离地对称分布,因此CH3Cl分子是极性分子而不是非极性分子。
Cl电子对,所以CH3Cl分子中的四个共价键就不可能最大距离地对称分布,因此CH3Cl分子是极性分子而不是非极性分子。
以上规律一旦熟练地掌握,就能迅速地从分子式判断出分子的极性问题。
分子正负电荷重心是否重合速判法:
判断分子正负电荷重心是否重合的前提就是首先要懂得分子的结构,只有知道分子结构,才可判断分子的正负电荷重心是否重合。这与力学中的重心分析问题是相似的。分子的正负电荷重心重合,该分子就是非极性分子,正负电荷的重心不重合,该分子就不是非极性分子,而是极性分子。
要使分子有极性,那么,构成该分子的化学键首先要有极性键。无极性键的分子,就不可能是极性分子(如:一切单质分子都不可能是极性分子,因为它们根本不含有极性键。)因此,对无极性键的分子,我们就不用再分析其正负电荷是否重合这个问题就可马上断定此分子不属极性分子了。
其次就是分析各个化学键的原子所带的电荷的电性和电量的大小。然后再根据力学求重心的方法求出分子中正负电荷的重心各在何处,接着判断它们是否重合。
下面举实例加以说明:
实例:分析CO2是极性分子还是非极性分子。
【分析与解】根据最外层的电子数和最大对称原理分析知:CO2必是直线型分子。如下:
O=C=O
其中两个C=O双键都相同,在C=O中,氧原子夺得电子能力比碳强,所以氧带负电、碳带正电。在共价键中的非金属原子都不是完全失去电子和完全得到电子。所以一般不宜象离子那样标出电荷量,一般只用“δ”这个符号表示少量电荷,少量正电荷表示为“δ+”,少量负电荷表示为“δ-”,对CO2的电荷分析如下:
δ-O![]() δ+Cδ+
δ+Cδ+![]() Oδ-
Oδ-
这样,CO2分子的正电荷重心就落在碳原子上,而两个等量的负电荷分别落在两个氧原子上,两个氧原子距离碳原子相等,且与碳原子同在一直线上,所以这两个负电荷的重心也必落在碳原子上(即落在两个氧原于连线的中点上),因此CO2分子的正负电荷重心重合,故CO2为非极性分子。图示如下:
![]()
实例:分析H2O分子是否极性分子。
【分析与解】根据原子最外层的电子数和最大对称原理可知:H2O的结构为V(形结构)。如下图所示:
![]()
其正负电荷分布如下所示:
从此可知,负电荷的重心落在氧原子上,正电荷等量分布在两个氢原子上。所以正电荷的重心必落在两个氢原子连线的中点上。如右下图所示:

从上显见,H2O分子的两个正负电荷重心不重合,所以H2O分子为极性分子。
实例:分析CCl4分子是否非极性分子。
【分析与解】根据各原子最外层的电子数和最大对称原理分析知,CCl4分子结构为正四面体。如右图所示:四个氯原子位于正四面体的四个顶角上,碳原子位于正四面体的重心(中心)。CCl4的正负电荷分布如右图所示:
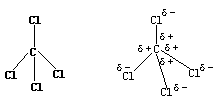
显示,CCl4分子的正电荷全部集中在碳原子上,即正电荷的重心落在正四面体的重心上,而四个负电荷(等量)分布在正四面体的四个顶角上,所以这四个负电荷的重心也必落在这个正四面体的重心上,因此CCl4分子的正负电荷重心重合,故CCl4分子也为非极性分子。
实例:分析NH3分子是否极性分子。
【分析与解】根据各原子最外层的电子数和最大对称原理可知NH3分子的结构为三角锥型结构。如下图所示:
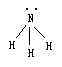
其中n(原子位于锥型结构的顶角上),三个氢原子位于底面正三角形的三个顶角上,NH3分子的正负电荷分布如下图:
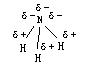
显见,NH3分子的负电荷全部集中在氮原子上,三个氢原子的正电荷分布在底面正三角形的三个顶角上,因此这三个等量正电荷的重心必落底面正三角形的重心上。如下图所示:
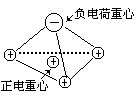
显见,正负电荷的重心必不重合,所以NH3分子为极性分子
实例:分析CH3Cl分子是否极性分子。
【分析与解】根据各原子最外层的电子数和最大对称原理可知。CH3Cl的分子结构为四面体结构,但不是正四面体。如外图所示:
在Cl——C键中,氯带负电,碳带正电,在C——H键中碳带负电(更弱的负电)。电荷分布如右图:
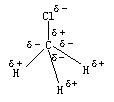
看上图可见,有一个负电荷分布在Cl原子上,有3个负电荷分布在C原子上,这样负电荷的重心必落在Cl与C连线靠近碳原子的一端上,四个正电荷分布在三个氢原子,一个碳原子,即分布在由这四个原子构成的四面体的四个顶角上,因此正电荷的重心必落在这个小四面体的重心上。如右图所示:
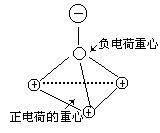
从上分析显见,CH3Cl分子的正负电荷重心不重合。所以CH3Cl分子为极性分子。因此CH3Cl也必很难溶于水。

- 全部评论(0)
(471037890) 评论 分子结构规律——最大对称:臭氧是极性分子,也是单质。
