也谈磷酸的氧化性
时间:2016-01-21 15:17 来源:未知 作者:汪谦 点击: 次 所属专题: 磷酸
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
现行中学化学教材在讲叙磷酸的化学性质时,认为“磷酸不显氧化性”。翻阅有关大专教材,提法也不尽一致。近年来,有些刊物对此问题进行了讨论,其主要观点可概括如下:
1.从磷酸有关电极反应来看,PO43-离子在酸性和碱性介质中有变为低价的倾向,所以,在一定条件下,磷酸具有氧化性;
2.PO43-离子不管在酸性或碱性介质中不具有氧化性。磷酸的氧化性是由酸电离出的氢离子所致。并认为,在中学范围内的酸,在一定条件下都具有氧化性;
3.由于PO43-离子很稳定,成酸元素的氧化数不发生改变,有关电极反应是负值,故磷酸无氧化性;
4.氢离子的氧化性属于酸性,而酸的氧化性系指酸根或酸分子本身而言,故认为氢离子的氧化性与酸的氧化性不是一回事。
笔者在认真学习以上同志观点的同时,对有关资料进行了研究,下面谈谈我们对这个问题的看法。
一、应分清酸的氧化性和氧化性酸这两个不同的概念
我们知道,一种物质其组成的原子或离子的氧化数减少,这种物质叫做氧化剂;反之,称之为还原剂。根据这一定义,酸的氧化性应包括酸电离出的氢离子和酸根离子的氧化性。由于氢离子的氧化性是酸的通性,所以,通常我们并不把它作为区分酸是氧化性酸还是非氧化性酸的标准。否则,会出现所有的酸都是氧化性酸这一结论,这样,对酸的氧化性的区分就失去了意义。通常我们是以酸根离子有性质作为区分酸是不是氧化性酸的标准。我们把酸根离子具有强氧化性的酸(如硝酸、浓硫酸等)叫作氧化性酸;而把酸根离子不具有氧化性(如氢卤酸、氢硫酸等)和氧化性很弱的酸(如磷酸等)叫作非氧化性酸。但这样的分类,丝毫不意味着酸中H+的氧化性不属于酸的氧化性。如果H+的氧化性不属于酸的氧化性,那么,在Zn+H2SO4(稀)=ZnSO4+H2↑这一反应中,稀硫酸到底有没有氧化性?是不是氧化剂?这势必引起概念上的混乱。我们认为,不管是酸中H+还是酸根离子的氧化性均属于酸的氧化性。不管是浓硫酸还是稀硫酸,在一定条件下都具有氧化性,只不过在浓硫酸中起氧化作用的是SO42-,而在稀硫酸中起氧化作用的是H+。不能认为只有酸根离子氧化数发生变化的酸才具有氧化性,而忽略酸电离出的H+的氧化性。应分清氧化性酸和酸的氧化性这两个不同的概念。
另一方面,由于H+参与含氧酸根离子的电极反应,所以,溶液的pH是影响含氧酸及其盐的氧化还原性的重要因素之一。从离子极化观点看,酸化时,含氧酸中M=O键质子化。由于H+强烈吸引电子,电子云密度向H+转移,使中心离子电正性增高,具有更强的接受电子的能力,因而其氧化性增强。这就是为什么含氧酸根离子在酸性介质中具有较强氧化性的原因。这也进一步说明了酸根离子的氧化性与氧离子的性质是密切相关的,不应把二者割裂开来,应从酸这个统一体来考察酸的氧化还原性质。
二、物质氧化性强弱是相对而言的,是随条件而变化的
影响物质氧化还原性的因素很多,也很复杂。物质的氧化还原性质不仅与浓度、温度、反应介质等条件有关,而且还取决于另一反应物氧化性的相对强弱。在反应SO2+2H2S=2H2O+3S中,SO2是氧化剂,遇到
![]()
离子在酸性介质中具有很强的氧化性,而在中性溶液中氧化性却很弱;在水溶液中,铜可以从可溶性银盐溶液中置换出银,而在氰化钾溶液中却是Ag置换出溶液中的铜:
Cu+2Ag+=2Ag+Cu2+
![]()
象这样的例子是很多的。这就说明,物质的氧化、还原这对矛盾是对立的统一,是相对的,不是绝对的。判断一个氧化还原反应能否进行,取决于有关电极反应电势差的大小,即ε=E正-E负。ε越大,反应越易进行。不能仅仅根据E0值的正负来判断某一物质是否具有氧化性。例如,金属钠与水的反应有关电极的E0值都是负值,但ε0是正值,反应的趋势很大。
Na++e![]() Na E0=-2.713V
Na E0=-2.713V
H2![]() 2H++2e (〔H+〕=10-7mol/L) E0=-0.4144V
2H++2e (〔H+〕=10-7mol/L) E0=-0.4144V
ε0=-0.4144-(-2.713)=2.2986(V)
所以,含氧酸的E0值必须是正值才具有氧化性的看法,起码在理论上是欠妥当的。
三、为什么磷酸氧化性很弱
有人认为,磷酸氧化性很弱的原因是由于PO43-离子中有d-pπ键形成,使磷酸分子很稳定。事实上,与磷酸同周期的硫酸、高氯酸分子构型也为四面体,在分子中也能形成d-pπ键。有关数据如下:
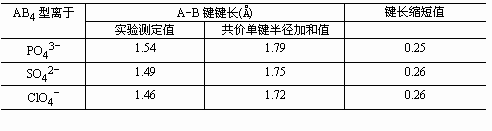
从以上数据可以看出:d-pπ键对这三种酸根离子的影响大致是相同的,造成磷酸氧化性很弱的根本原因是由于P=O键的键能较大(键的平均结合能:Cl=O 240kJ·mol-1,S=O 485kJ·mol-1,P=O 620kJ·mol-1),而硫酸、 高氯酸却是强氧化剂。鲍林认为,这种性质上的差异,可根据元素电负性的不同来说明,两元素在电负性标度上相距越远,则它们之间所成键也越强。这三种元素电负性:Cl为3.0,S为2.5,P为2.1,由此可知,这三种元素与氧所成键的稳定性,按Cl、S、P的顺序而增加。正由于P=O键键能较大,故PO43-离子很稳定,造成了磷酸的氧化性很弱。
四、结束语
综上所述,笔者认为,在通常情况下,磷酸是一种氧化性很弱的酸。在较高温度下,磷酸及盐的氧化性显著增强,可与金属等充分反应并被还原。例如:
2Ca3(PO4)2+6SiO2+10C=6CaSiO3 +P4+10CO↑;Na3PO4+4Mg=4MgO+Na3P
磷酸在水溶液中的氧化性,主要是由酸电离出的H+所致。考虑到氧化性强弱这一概念的相对性及对含氧酸氧化性分类的特殊性(即根据酸根离子的氧化性把酸分为氧化性酸和非氧化性酸),笔者认为,把磷酸的氧化还原性质表述为:“在通常状况下,磷酸是一种氧化性很弱的酸”或“磷酸是一种非氧化性酸”较为妥当,不致引起概念上的混乱,给教学带来困难。

- 全部评论(0)
