水解反应面面观
时间:2016-01-08 22:24 来源:未知 作者:周广 点击:次 所属专题: 水解反应 有机反应
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
所谓水解反应,即物质跟水发生的相互变换成分的反应.用通式可表示为:
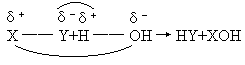
反应的机理可简单地认为是:共价键(X—y键、H—O键)断裂(一般地,一个水分于中只有一个H—O键断裂),再按异电相吸原则,重新组合成新键即得产物.至于离子键则视为共价键的极限情形.各类水解反应及其应用列举如下:
一、无机物的水解
1.单质的水解
![]()
2.氧化物的水解
P4O6+6H2O(热)=3H3PO4+PH3
3.盐类的水解
机理:盐的离子(一般是弱酸的阴离子或弱碱的阳离子)跟水电离出来的H+或OH-结合形成弱电解质,从而促进水的电离.如:
NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
![]()
基本规律:“有弱就水解,无弱不水解,谁弱谁水解,谁强显谁性.”
4.非盐型离子化合物的水解
这类水解主要是指活泼金属的氢化物、氮化物、磷化物、碳化物等的水解.如:
CaH2+2H2O=Ca(OH)2+2H2↑
Mg3N2+6H2O=3Mg(OH)2+2NH3↑
Ca3P2+6H2O=3Ca(OH)2+2PH3↑
Na3As+3H2O=3NaOH+AsH3↑
(以上二式是膦和胂的制法)
CaC2+2H2O→Ca(OH)2+C2H2↑
类似地不难写出Sr3N2、MgC2、Al4C3等的水解.如:
Al4C3+12H2O→4Al(OH)3↓+3CH4↑
此类反应的机理是:离子键断裂,而水电离成H+和OH-,产物是金属的氢氧化物和二元非金属氢化物(或H2).
5.焦酸的水解
H2S2O7(焦硫酸)+H2O=2H2SO4
H4P2O7(焦磷酸)+H2O=2H3PO4
6.非金属卤化物的水解
(1)卤素互化物(XX'N=1,3,5,7)的水解.如:
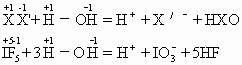
规律一般是分子中核电荷数较大的卤原子(电负性较小)生成卤氧离子,而较小的卤原子则形成卤离子或氟化物.
(2)氮族元素卤化物的水解.如:
![]()
![]()
水解得NH3和HClO,而HClO是强氧化剂,再将NH3氧化成N2.
PCl3+3H-OHp(OH)3+3HCl
AsX3+3H2O=H3AsO3+3HX
SbCl3+H2O=SbClO↓+2HCl
此外,还有BCl3+3H2O=H3BO3↓+3HCl↑等.
二、有机物的水解
1.卤代烃的水解,
如:
![]()
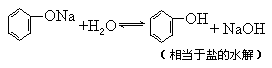
2.醇钠、酚钠的水解,
如:C2H5ONa+H-OH→NaOH+C2H5OH,由于C2H5OH具有比水更小的电离度,故C2H5ONa碱性比NaOH更强.
3.羧酸衍生物的水解,
如:
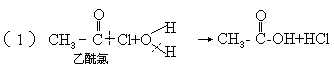
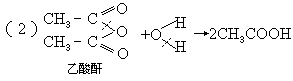
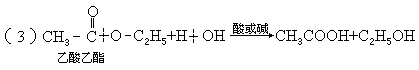
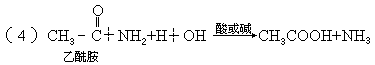
规律此类水解分别是酰卤键、酰氧键、酰胺键断裂,并都得到了羧酸.
4.腈的水解,
如:
![]()
这是制羧酸的方法之一.
5.糖类的水解

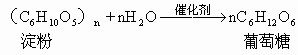
6.多肽、蛋白质的水解
通常是肽键(![]() )断裂,水解的最终产物是α-氨基酸.
)断裂,水解的最终产物是α-氨基酸.
7.有机加成中间体的水解
(l)烯烃的臭氧化水解,如:
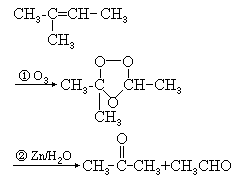
还原水解的产物是醛或酮.此反应常用来研究含双键化合物的结构.
(2)用格氏试剂制醇
如:
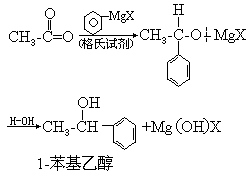
这是制备醇的好方法.只要选择适当的格林试剂和醛、酮,即可合成具有指定结构的各类醇.

- 全部评论(0)
