基于原电池学习锂离子电池
时间:2017-04-26 09:18 来源:未知 作者:爱莉 点击:次 所属专题: 原电池工作原理 锂离子电池
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、概述
锂离子电池是一种质轻环保的可再生新能源,与社会生活密切相关,已广泛应用在电子产品中,如手机、笔记 本电脑、照相机等。因此,学习和了解锂离子电池的相关 知识对于学生的学习是非常必要的,可以培养学生知识源 于生活又服务于生活以及理论联系实际的辩证思维。
研究近年的高考考题发现,电化学中的原电池和电 解槽等相关知识是考试的热点和重点,特别是最近一两 年中,在原电池的基础上衍生出的有关锂离子电池的题 目越来越多,如2013年全国理综新课标卷I 27题和 2014年安徽理综卷27题,考査的均是锂离子电池的相 关知识。这说明学生不仅掌握书本知识,还要在社会生活中学习相关化学知识,从而理论联系实际。本文主要在原电池的基础上探究锂离子电池的学习。
二、原电池结构及基本原理
原电池是将化学能转化为电能的装置,主要由电极、电解 质和隔膜组成。图I所示是原 电池的基本结构,
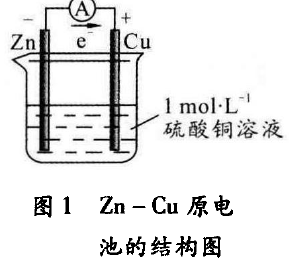
正极材料一 般是较不活泼的金属材料或导 电碳及金属氧化物,如Ag、C、Cu、MnO2等;负极一般是较活泼的金属,如Li、Zn、Fe等;电解质一般是强电解质溶液或熔融电解质,因为强电解质不仅可以完全电离出离 子,而且在电场作用下,可以提高离子定向迁移的速率, 降低电池的内阻。隔膜主要是为了阻止正负极直接接 触导致短路,但是允许离子自由通过,一般隔膜分为水系隔膜(如蓄电池中的隔膜)和有机系隔膜(锂一次电池 隔膜)。
现以锌为负极,铜为正极,1 mol • L-1的硫酸铜为电 解液,介绍原电池的基本原理。锌失去2e-,电子经过外电路,通过电流表到铜电极。由于电场作用,内电路中电解质溶液的离子定向移动,阳离子(Cu2+、H+ )向正极 移动,阴离子(SO42-、OH-)向负极移动。Cu2+的氧化性 比H+强,更容易得到电子,根据电荷平衡原理,Cu2+得 到从外电路中转移过来的2e-,在铜电极上生成铜,这个 过程就完成了原电池的放电过程。其电极反应式为:
负极(Zn) :Zn-2e- =Zn2+
正极(Cu) :Cu2++2e- = Cu
总反应:Zn + Cu2+=Cu + Zn2+
三、锂一次电池的结构及原理
若将上述的正极Cu换成MnO2,负极Zn换成Li片, 电解质溶液CuSO4换成固体盐类(LiCl、LiBr)或溶解于 有机溶剂的盐(LiClO4、LiBF4等),像这种以Li片为负 极,金属氧化物或其他氧化剂物质为正极,固体盐类或 溶解于有机溶剂的盐类为电解质所构成的原电池装置 就是锂一次电池。锂由于质量轻、比容量高、能量密度 大而用作电池的负极材料,但是锂是一种非常活泼的 碱金属,遇水会发生反应生成氢气,故选择的电解质要避免含水分。因此,常用无机含锂盐为电解质(如 LiClO4、LiAsF6、LiAlCl4、LiBF4、LiBr 等),其正极材料一 般为二氧化锰、氧化铜、三氧化钼等。其中Li-MnO2锂 一次电池工作原理和上述Zn - Cu原电池基本相同,其电极反应式为:
负极(Li):Li-e- =Li+
正极(MnO2) :MnO2 +e-= MnO2
总反应:Li+MnO2=LiMnO2
但是,锂一次电池在放电过程中容易在Li表面形成枝晶,易刺破隔膜使正负极接触导致短路,严重时会产 生爆炸,故要寻找新的正负极电极材料。
四、锂二次电池的结构及原理
为了防止发生锂一次电池放电过程中产生的锂枝 晶现象,使锂电池更加安全可靠,人们发现用锂离子在 充放电过程中在正负极化合物之间进行嵌人/脱出,正 负极材料均能可逆地接收锂离子的进出,而对材料的结 构不造成任何影响和破坏。像这种可充放电的电池称 为锂二次电池,主要由正极、隔膜、电解液、负极和集流 体等组成。正极材料主要有电位比较高的过渡态金属 化合物,常见的主要有层状化合物LiMO2(M = Co、Ni、 Mn等)、尖晶石型化合物(LiMn2O4)和橄榄石型磷酸盐 LiMPO4(M = Fe、V、Ni、Co、Mn)等。负极材料主要是电 位接近金属锂电位的可逆嵌锂物质,常见的主要有碳材料、金属氧化物、合金等。这样的锂电池的电位更高,比能量也更大。电解液是固体锂化合物和溶于有机溶剂 的锂盐类,隔膜是有机系的。集流体分正负极,正极集流体一般是铝,负极集流体一般是铜。现在市场上应用 的锂电池正极材料是LiCoO2,负极材料是石墨。
锂离子电池工作原理下图所示
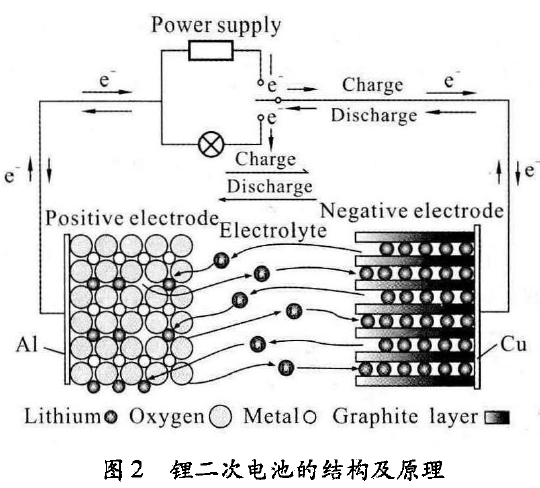
当电池充电时,锂离子从正极材料活性物质中脱出,在外电压的电势梯度驱使下,锂离子经过电解质的传递,经过隔膜,嵌人到负极材料石墨中,根据电荷平衡原理,等量的电子从正极材料经过外电路到负极材料, 这样一个充电过程就完成了;当电池放电时,过程就与充电过程相反。电池的反应为:
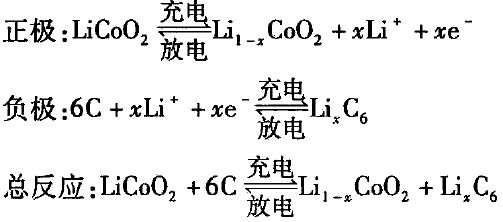
五、结论
综上所述,原电池的基本原理是掌握其他电池的基 础和根本,在此基础上逐步介绍了锂一次电池、锂二次 电池的结构和基本原理,对于学生的学习起到了承前启 后的作用,为社会生活中其他电池的学习打好了基础。 学习化学要与社会生活紧密联系在一起,培养理论联系 实际的唯物主义辩证观,提升学生的知识技能和考试应试能力。

- 全部评论(0)
