离子极化理论及其在中学化学教学中的应用
时间:2016-03-21 17:55 来源:未知 作者:胡中宇 点击:次 所属专题: 离子极化
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在中学化学教学中,经常遇到关于物质的颜色,熔点与沸点,溶解度、键性、酸碱性、晶型、热稳定性等一些物理及化学现象。如何来解释它?根据什么理论基础?这对加深无机物性质的理解、学好无机化学、提高中学化学教学质贵很有意义。离子极化理论对解释无机物的性质提供了较好的理论基础,它体现了直观的方法,浅而易懂的理论基础,定性的回答了上述有关的问题。为此特总结一下,供广大中学化学教师和从事无机化学教学的同志们参考。
一、什么叫离子极化?
凡离子受到外介电场作用后,使离于本身的正负电荷重心发生相对位移,从而使离子产生了“极性”的过程称为“离子极化”。参看下图:

但是,由于离子本身带有电荷,能产生电场,因此,离子可使其带异电荷的离子发生“极化”。
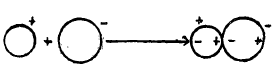
离子极化的结果是:异电荷离子最外层的电子云发生了“变形”。
“极化”一与“变形”是一对矛盾。凡离子的极化力愈大,表现在被极化的异电荷离子的变形性就愈大。
根据阴阳离子的特征性质,通常认为离子的极化作用是指阳离子对阴离子的极化。这是因为阳离子具有多余的正电荷,一般半径较小,外壳缺少电子,对相邻的阴离子易发生诱导作用,而阴离子一般半径较大外壳有较多电子,易发生变形,因此阴离子易被阳离子诱导而产生诱导偶极之故。
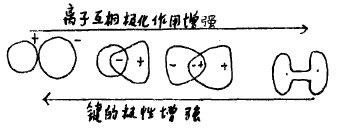
二、离子的互相极化作用
事物总是互相联系互相影响的。当阴、阳离子互相作用时,阴离子被极化后,产生诱导偶极,又反过来诱导阳离子(特别是易变形的阳离子)并产生诱导偶极。这种阴阳离子互相产生诱导偶极从而加强离子间吸引力的过程,称为离子间的互相极化作用或称离子间的附加极化效应。参观下图:
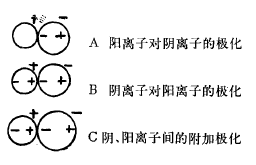
C阴、阳离子间的附加极化离子互相极化作用的结果是:阴、阳离子皆发生了变形,即阴离子的电子云向阳离子偏移,阳离子的电子云向阴离子偏移,从而使阴、阳离子间产生了附加的吸引力,使两离子间电子云发生了重迭,因而使两核间距离缩短,造成离子键向共价键转变的条件。参看下图:
三、离子的反极化作用
在外介离子的作用下,削弱了异电离子间极化作用的过程,称为离子的反极化作用。
例如:在CO32-离子中,C4+离子极化了周围三个氧原子,如下图。
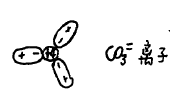
在外介电场碱上金属离子M2+作用下,仅极化了邻近的一个氧原子,并缩短了这个氧原子的偶极矩。因而削弱了这个氧原子与碳原子之间的结合力称为离子的反极化作用。这种反极化作用愈大,该碳酸盐愈不稳定,即愈易
分解,参看下图:
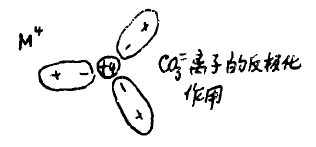
理论与实践证明,按Be2+、Mg2+、Ca2+、Sr2+、Ba2+顺序,离子的反极化作用递减,但其碳酸盐的热稳定性却递增。参看下表:
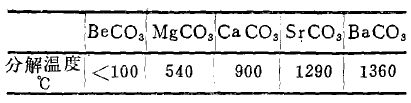
浓热H2SO4具有强烈的氧化作用,而稀H2SO4则无氧化性(指SO42-部分),也可用离子的反极化作用得到解释。这是因为在SO42-中,S+6的周围被四个氧原子所包围,而且较稳定。但在浓H2SO4条件下,其中主要以H2so4分子状
态而存在,即H+以强烈的反极化作用而钻入到SO42-内部,从而削弱了S+6与四个氧原子间的极化作破坏了S+6周围四个氧原子的包围,降低了SO42-离子的稳定性。结果是,在还原剂的作用下,可使S+6获得电子而被还原。参看下图:
可见,H+离子的反极化作用结果,降低了SO42-的稳定性,使SO42-在还原剂作用下,有可能获得电子而具有氧化性。发生氧化后,浓H2SO4本身还原成SO2或S。但在稀H2SO4中,则H+离子以水化离子形式存在于溶液中,水化H+离子不能钻入SO42-内部而发生离子的反极化作用,保存了SO42-的稳定性,故稀H2SO4无氧化性。
四、离子极化理论要点
(一)离子极化作用强弱的一般规律
1·离子的电荷。
一般是带正电荷愈多的阳离子,其极化作用愈强。
2离子的大小。
一般是阳离子愈小,其极化力愈强。当离子的电子外壳构型相似,电荷相等时,则离子半径愈小,其极化作用愈强。
3.离子的电子外壳构型。
阳离子的电子外壳构型的极化力强弱顺序是:
8电子外壳构型<9~17电子外壳构型<18,18+2,8+2,2电子外壳构型
这是因为s、p态电子云的屏蔽效应较大,致使8电子外壳构型的离子,其有效核电荷减少的结果。而d态电子云的屏蔽效应较小,致使9一17,18,18+2等电子外壳构型的离子,仍保持较强的核电荷,因而有了较强的极化力。
(二)离子变形作用强弱的一般规律
1.离子的电荷。
一般是负电荷越高的阴离子,其变形性愈大,正电荷越高的阳离子,其变形性愈小。
对电子外壳构型相同的离子,其变形顺序举例如下:
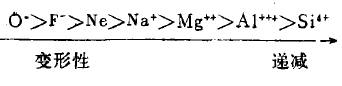
2.离子半径的大小
对相同或类似结构的离子讲,一般是:凡离子半径愈大,其变形性愈大。
例:Li+<Na+<K+<Rb+<Cs+
变形性递增
3离子的电子外壳构型
以阳离子的电子外壳构型为例:
18、9~17电子外壳构型的变型性>同半径的8电子外壳电子构型的变形性。
这是因为d态电子不仅屏蔽效应较小,而且d态电子本身易发生变形之故。
因此凡有d态电子填充的18、9~17电子外壳构型的离子,其变形性就愈大。
通过以上讨论看出:
最易变型的离子是:体积大的阴离子,18电子外壳构型的阳离子(如Ag+、Zn2+等),不规则(9~17)电子外壳构塑的阳离子(如Fe2+、Ni2+等)。
极化力最强的离子是:半径小,正电荷高,以及2,18,18+2;8+2等电子外壳构型的阳离子。
五、离子极化理论对无机物性质的解释
(一)无机物的颜色
一般是,凡离子有颜色,其化合物就有了颜色,也有的离子本身虽无颜色,但却能形成有色化合物,例如Ag+离子与I-离子皆无颜色,而形成AgI后,却变为黄色,这是离子极化作用的结果。极化后,便激发态与基态的能差变小,其能差正等于可见光的范围,因而AgI就有了颜色。
AgF(白色)、AgCI(白色)、AgBr(淡黄色)AgI(黄色),其颇色的深浅度,按F一Cl一Br一I的顺序加深,这也是由于卤素离子中,按上列顺序,离子互相极化作用增强之故。
例如Ag+离子与I-离子间互相极化作用最强,其基态与激发态能量差愈小,愈接近可见光中的深色部分,故其颜色越深。
Pb(OH)2为白色,PbO为黄色,PbS为黑色,这是因为S2-离子的变形性比O2-离子变形性大,而O2-离子的变形性又比OH-离子的变形性大,因此Pb++离子与S离子的互相极化作用比Pb2+离子与O2-离子的相互化作用增大,而Pb2+离子与O2-离子的互相极化作用又比Pb2+离子与OH-离子的互相极化作用增大。结果是Pb(OH)2一PbO一PbS的颜色,按上列顺序加深。
有的高价氧化物其有颜色,例如CrO4-离子为黄色,MnO4-离子为紫色,这是因为Cr+7、Mn+7具有较强极化作用之故。
(二)无机物的熔点与沸点
以NaCl与AgCl为例进行比较。它们的晶格虽相同(皆为NaCl晶型,配位数为6),而且其晶格常数d也几乎一致(dNaCl=2·81 ,dAgCl=2.77
,dAgCl=2.77 )但NaCl的熔点却为800℃,AgCl的熔点却为455℃。实践证明AgCl的熔点显著下降。
)但NaCl的熔点却为800℃,AgCl的熔点却为455℃。实践证明AgCl的熔点显著下降。
这是因为Ag+离子与Cl-离子互相极化作用的结果,增加了类似加热的过程,因而AgCl的熔点降低。
比较HgCl2与CdI2的熔、沸点:参看下表:
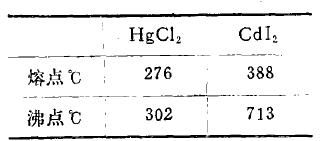
不难看出:它们的熔点与沸点皆较低。这是由于Hg2+与Cd2+离子皆具有较强极化作用,而Cl-离子有相当大的变形性,I-离子的变形性更大,因此它们之间互相极化作用的结果,使HgCl2和CdI2的熔点和沸点皆有所降低。
无机物熔、沸点降低的一般规则是:
多数具有18电子或不规则电子外壳构型的阳离子所形成化合物的熔、沸点较8电子外壳构型的阳离子的同类化合物的熔、沸点为低。
(三)无机物的溶解度。
根据无机物的“结构相似互溶”原则,可知无机物的溶解度与无机物的化学键很有关系,而离子间能否发生极化作用,能否引起化学键型的转变,对无机物的溶解度是有影响的。
现以金属硫化物的溶解度不同进行讨论如下:凡金属离子与硫离子间极化作用愈强则硫化物的共价性愈大,其溶解度就愈小。
例如8电子外壳构型的离子(Na+、Ca2+……)的极化力很弱,其硫化物易溶入水,9~17电子外壳构型的离子(Mn2+、Fe2+、Co2+、Ni2+......)的极化力愈强,其硫化物的溶解度愈小,而具有18,18十2电子外壳构型的离子(Ag+、Pb2+.....)不仅极化力强,而且又易被阴离子所极化产生了附加极化效应,因而增强了总的极化作用,其硫化物的溶解度就更小
碱土金属的硫酸盐,其溶解度按Ca一Sr一Ba顺序减小,参看下表:

这是因为Ca2+,Sr2+,Ba2+离子与弱极性(S+6)的SO42-阴离子互相作用的结果,增强了附加极化作用,共价键性增强的缘故。
但在碱土金属的碳酸盐中,baco3的溶解度有所增加。
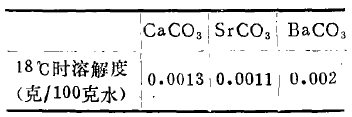
这是因为Ca2+,Sr2+,Ba2+离子与弱极性(C+4)的CO32-阴离子互相作用的结果,主要是阳离子对阴离子的极化,其附加极化作用,几乎并不发生,可忽略不计,结果是Ca2+、Sr2+离子半径愈小者,其极化作用增强,而离子半径较大的Ba2+离子与CO32-离子形成的BaCO3,其溶解度较大。
(四)无机物的晶型。
以ZnO与MgO的晶型为例,进行比较如下:
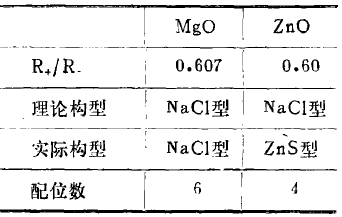
理论晶格构型,按R+/R-比值,凡在0.225~0.414之间者为ZnS型;凡在0.414~0.732之间者为NaCl型,凡在0.732~1之间者为CsCl型。
ZnO的实际晶格构型却为ZnS型,这是因为在MgO中,仅有Mg2+离子对O2-离子发生了单方面的极化作用,而在ZnO中,由于Zn2+离子与O2-离子互相极化作用的结果,致使ZnO离子间强烈地靠近,配位数显著减少,致使ZnO变为ZnS型。
(五)无机物的热稳定性
现以碳酸、碳酸氢盐、碳酸盐的热稳定性为例,进行讨论如下:
它们的热稳定性是:H2CO3<HCO3-<CO32-,(参看下图)
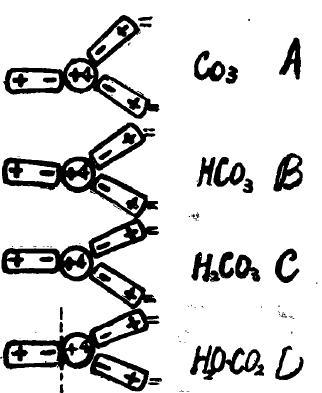
A:表示C+4极化了周围三个氧原子,并使氧原子变型,牢固结合在二起,形成稳定的CO32-离子。
B:表示由于H+离子体积小,带一个正电荷,可钻人O2-离子的电子云之中,发生了离子的反极化作用,从而降低了CO32-离子的电荷,形成HCO3-离子。降低了C+4与O2-离子间的极化作用,减弱了C一O间的化学键。所以HCO3-的热稳性小于CO32-的热稳定性。
C:表示2个H+离子皆钻入O2-离子的电子云中,形成H2O分子,这种反极化作用,进一步降低了C+4与O2-离子间的极化作用,从而减弱了C一O间的化学键。表明形成了H2CO3。
D:表示形成H2O分子后,依靠水分子本身的极性取向而保存在氧化数为+4的碳原子上,因而很易放出CO2,所以H2CO3的热稳定性小于HCO3-的热定性。
六、小结—对离子极化理论的评价
离子极化的概念是Fajans等人提出的。离子极化理论是建立在离子键理论基础上发展起来的理论。它的基本观点,就是从离子的观点出发,将一切化学结合,首先看成离子结合,因而它较系统并深刻地解释了离子化物的性质,即从离子的电荷、离子半径、离子的外壳电子构型的观点出发,观察分析阴、阳离子间的互相作用,从而定性的确认离子化物和部分无机物的性质,这点是很成功的。因此离子极化理论仍然是定性的解释无机物,特别是离子化物性质的重要理论之一。、它可形象化并直观定性的解释物质的性质,对提高中学化学教学质量具有重要意义。
但是离子极化理论却有一定的局限性。它的缺点表现在强调一切从离子观念出发,尚不能解释共价化合物中的许多无机物的性质。并且它还不能定量的更深入的探讨物质的性质,使人感到该理论停滞不前,不能令人满意。现代的酸碱理论,特别是软、硬酸碱理论对促进离子极化理论的发展,对解释无机物的性质,开辟了新的广阔前景。

- 全部评论(0)
