简介铬及其化合物的考点和考查方式
时间:2016-03-29 16:25 来源:未知 作者:邬兆宇 点击:次 所属专题: 重铬酸钾
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
近三年,有关金属铬及其化合物的考查内容 越来越多,值得关注。
一、铬元素在周期表中的位置及结构,尤其是 铬原子电子排布式,符合“洪特规则”
铬,一种金属元素,元素符号:Cr;,质硬而脆,抗腐蚀性强。用于电镀和制造特种钢。原子 序数为24,第四周期第VIB族。基态原子电子排 布式为1s22s22p63s23p63d54s1 或[Ar] 3d54s1,外围特征电子排布3d54s1。主要化合价有+3 和+ 6 。
二、氧化铬和氢氧化铬的两性,往往是无机工 艺流程题的“题眼”
1. 氧化格(Cr2O3)
(1) 物理性质
暗绿色晶体或绿色粉末;熔点为2266℃,沸 点为4000℃,密度为5. 21 g • cm -3;微溶于水。
(2) 化学性质
氧化铬具有两性;溶于硫酸,得紫色的硫酸铬(Ⅲ):
Cr2O3 +3H2SO4 =Cr2(SO4)3 +3H2O 溶于浓氢氧化钠,生成深绿色的亚铬酸钠: Cr2O3 + 2NaOH =2NaCrO2 +H2O
(3) 用途
氧化铬可用硫还原重铬酸钠制得,也可由重 铬酸铵热分解制得,氧化铬是生产金属铬的原料, 也是高温陶瓷和绿色颜料的材料。
2. 氢氧化铬[Cr(OH)3]
绿色粘性沉淀。不溶于水,溶于酸和强碱溶 液。用于制铬盐。将氨水加人铬盐溶液而制得。 受热分解而成三氧化二铬。因此氢氧化铬具有两 性,与氢氧化铝相似。
Cr3++3OH- Cr(OH)3
Cr(OH)3  H+ + CrO2-+ H2O
H+ + CrO2-+ H2O
三、重铬酸钾的强氧化性,尤其在氧化还原滴 定中,利用多步反应方程式建立首尾关系进行化学计算,是考查的热点
1.理化性状和用途
橙红色板状结晶,与可燃物接触可能着火。 密度为2. 676 g • cm-3。熔点为398℃。它在低 温下的溶解度极小,又不含结晶水,易通过重结晶 法提纯;也不易潮解,故常用作分析中的基准物。
本品为用途极广的铬化合物。
2. 毒性
+ 6价铬毒性大于+3价铬。铬还是一种致 敏源,+6价铬有刺激性和腐蚀性,铬是一种致癌 物。
3. 应用
由于重铬酸钾在酸性条件下具有强氧化性, 实验室中常用它配制铬酸洗液(饱和重铬酸钾溶 液和浓硫酸的混合物),来洗涤化学玻璃器皿,以 除去器壁上的还原性污物。使用后,洗液由暗红 色变为绿色,洗液即失效。
重铬酸钾还应用于分析化学,常用来定量测 定还原性的氢硫酸、亚硫酸、亚铁离子等。在加热 时,重铬酸钾还能氧化浓盐酸,放出氯气。
化学平衡上的转变:向铬酸盐溶液中加人酸 时,溶液由黄色变为橙色,向重铬酸盐溶液中加人 碱时,溶液又由橙色变为黄色。
2CrO42-(黄)+ 2H+  2HCrO4-
2HCrO4- Cr2O72-(橙红)+H2O
Cr2O72-(橙红)+H2O
交警用经硫酸酸化处理的三氧化铬(CrO3 (与重铬酸钾原理类似)硅胶检查司机呼出的气 体,根据硅胶颜色的变化(硅胶中的+6价铬能被酒精蒸气还原为+3价铬,颜色发生变化,同时根 据平衡移动原理,发现喝的越多一般颜色越深。 橙黄变灰绿),可以判断司机是否酒后驾车。
4. 重铬酸钾的特殊反应
(1) 重铬酸钾制取光气
重铬酸钾与四氯化碳反应会产生光气和液态 二氯铬酰,不是氧化还原反应。化学方程式如下:
K2Cr2O7 +3CCl4 =2KC1+2CrO2Cl2( 二氯铬酰)+3COCl2
(2) 制取过氧化铬的反应
重铬酸钾和双氧水的反应,同样不是氧化还 原反应。
Cr2O72-+4H2O2 +2H+ ==2CrO5 +5H2O
过氧化铬是蓝色结晶。不稳定,氧化性较强, 易分解出氧气,为增加其稳定性,反应须在冷水中 进行,并用乙醚等有机溶剂萃取。
典型例题1、重铬酸钾是工业生产和实验室 的重要氧化剂,工业上常用铬铁矿(主要成分为FeO • Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如图1,涉及的主 要反应是:
6FeO • Cr2O3 +24NaOH +7KClO3=12Na2CrO4 +3Fe2O3 +7KCl + 12H2O
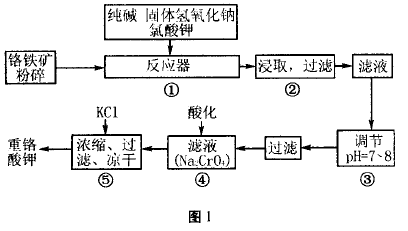
试回答下列问题
(1) 在反应器①中,有Na2CrO4生成,同时 Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的 化学方程式: _ 。
(2) NaFeO2能强烈水解,在操作②生成沉淀 而除去,写出该反应的化学方程式: 。
(3) 操作③的目的是什么,用简要的文字和 化学方程式说明: 。
(4) 操作④中,酸化时,CrO4-转化为Cr2O72-, 写出平衡转化的离子方程式: 。
(5) 称取重铬酸钾试样2.5000 g 配成250 mL 溶液,取出25.00 mL 于碘量瓶中,加人10 mL 2 mol/LH2SO4和足量碘化钾(铬的还原产物为 Cr3+),放于暗处5min,然后加人100 mL 水,加人 3mL 淀粉指示剂,用0.1200 mol/L Na2S2o3标准溶 液滴定(I2+2S2O32-==2I- +S4O62-)。
①判断达到滴定终点的依据是 :__ 。
②若实验中共用去Na2S2O3标准溶液 40.00 mL,则所得产品中的重铬酸钾的纯度(设 整个过程中其它杂质不参与反应): 。
解析该题考査学生在“化学方程式的书 写、反应条件控制、氧化还原滴定及多步反应计 算”等方面对元素化合物性质及其转化关系的理 解和应用程度。本题中“NaFeO2能强烈水解”考 査学生对新信息的处理能力。
参考答案:
(1) Al2O3 + Na2CO3 =2NaAlO2 + CO2
(2) NaFeO2+2H2O=Fe(OH)3 + NaOH
(3) 由于溶液中硅酸钠和偏铝酸钠发生水 解,降低pH值有利于水解平衡向正反应方向移 动,当pH调到7 ~ 8时,使它们水解完全,从而除 去 SiO2和 AlO2-。
(4) 2CrO42- +2H+ Cr2O72- +H2O
Cr2O72- +H2O
(5) ①当滴加最后一滴硫代硫酸钠溶液,溶 液蓝色褪去,半分钟内不复现;②94.08%。
典型例题2、红钒钠(重铬酸钠:Na2Cr2O7 • 2H2O,橙红色晶体)是重要的化工原料。工业铬 铁矿(FeO •Cr2O3,含少量Al2O3和SiO2)按图2 过程来制取红钒钠。
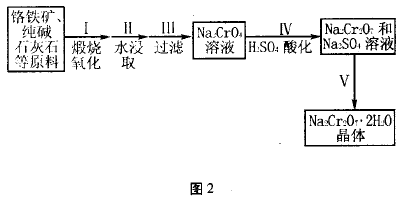
(1 )步骤I的反应有:4FeO • Cr2O3 + 8Na2CO3 +7O2 =2Fe2O3 +8Na2CrO4 +8CO2,生成1 mol Na2CrO4转移的电子数为____________ mol;原料中加人CaCO3的作用是__________ 。
A. 分解产生CaO,与某些杂质反应形成炉渣
B. 分解时放出大量热量,提高煅烧温度
C. 分解产生CO2从下而上穿过,使得炉料翻 滚,加快原料的煅烧氧化
(2)浸取液中含有铝和硅的化合物,步骤III 过滤前要用稀H2SO4将浸取液的pH调至7 ~ 8, 并煮沸除去铝和硅的化合物,其离子方程式为:
(3 )步骤IV反应为:2CrO42-+ 2H+  Cr2O72-+ H2O,平衡常数表达式为: 。
Cr2O72-+ H2O,平衡常数表达式为: 。
图3是Na2Cr2O7 •2H2O和Na2SO4的溶解度曲线。
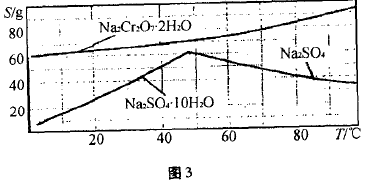
(4)据此,步骤V(操作的方法是):将汉所得溶液___ (填操作),趁热过滤得到的晶体是 (填化学式);然后将所得溶液 (填操作),得到的晶体是__ 。
解析该题涉及氧化还原反应、离子方程式 的书写和化学平衡常数,同时考査学生对溶解结 晶实验中化学原理的理解程度、对图表数据的评 价分析能力、对实验步骤的表达能力和实验研究 结果的应用能力。
参考答案(1)3.5;A、C
(2)H+ +AlO2- + H2O=Al(OH)3
SiO32- +2H+ =H2SiO3
(2) K =c(Cr2O72-)/[c2(CrO42-) ×c2(H+)]
(3) 蒸发浓缩;Na2SO4;冷却结晶,过滤; Na2Cr2O7•2H2O。
典型例题3、 随着工业的迅速发展,产生的 废水对水体的污染也日趋严重。通过控制溶液的 pH对工业废水中的金属离子进行分离是实际工 作中经常使用的方法。表1是常温下金属氢氧化物的Ksp(沉淀溶解平衡常数)和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时 溶液中有关金属离子产生沉淀的最小浓度;当溶液中金属离子浓度小于10-5 mol• L-1时通常认为该离子沉淀完全)。

(1)某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0. 1 mol • L-1。为除去其中的 Fe3+,回收铜,需控制的pH范围是 。
(2)为了处理含有Cr2O72-酸性溶液的工业 废水,采用如下方法:向废水中加入适量NaCl,以 Fe为电极进行电解,经过一段时间,有Cr(OH)3 和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。
①Cr2O72-转变为Cr3+的离子方程式为 。
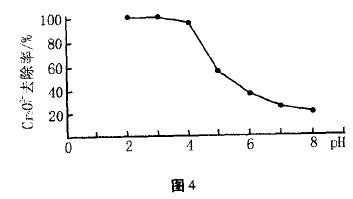
②pH对废水中Cr2O72-去除率的影响如图4。你认为电解过程中溶液的pH取值在 范围内对废水处理有利,请说明理由
(3) 沉淀转化在生产中也有重要应用。
例如,用Na2CO3溶液可以将锅炉水垢中的CaSO4转 化为较疏松而易清除的CaCO3,该沉淀转化达到平衡时,其平衡常数=_ (写数值)。[巳知 A:Ksp(CaSO4) =9.1 ×10-6 Ksp(CaC03) =2.8 ×10-9]
解析这是一道探究性较强的综合性化学问 题,该题以工业废水的处理为情景,考查学生通过 分析处理题给信息形成结论的能力、运用化学知 识解决相关社会问题的能力、对化学事实分析判 断的能力和对实验探究方案的评价能力等,题目 的开放性利于促进学生开放性思维能力的提高。 第(3)问学生必须建立沉淀溶解平衡:CaSO4 ( s) + CO32- (aq) CaCO3 ( s) + SO42- (aq),然后确 定 K =Ksp ( CaSO4 )/Ksp (CaCO3)。该小题综合考査 了学生运用化学知识和数学方法进行计算的能力。
CaCO3 ( s) + SO42- (aq),然后确 定 K =Ksp ( CaSO4 )/Ksp (CaCO3)。该小题综合考査 了学生运用化学知识和数学方法进行计算的能力。
参考答案:
(1) 3.7≤pH<4.7或3.7≤pH≤4.7
(2) ① Cr2O72-+6Fe2++ 14H+ ==2Cr3++6Fe3++7H2O
②4.3 ~5.6(或 5 ~6) pH 越小,Cr2O72-的去除率越大,但难形成Cr(OH)3沉淀从废水中分离;pH越大,Cr2O72-的去除率越小
(3) 3.25 ×105

- 全部评论(0)
