通俗讲义:氧化还原反应“正说与歪说”
时间:2020-03-05 10:48 来源:未知 作者:唐明再 点击:次 所属专题: 氧化还原反应概念
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
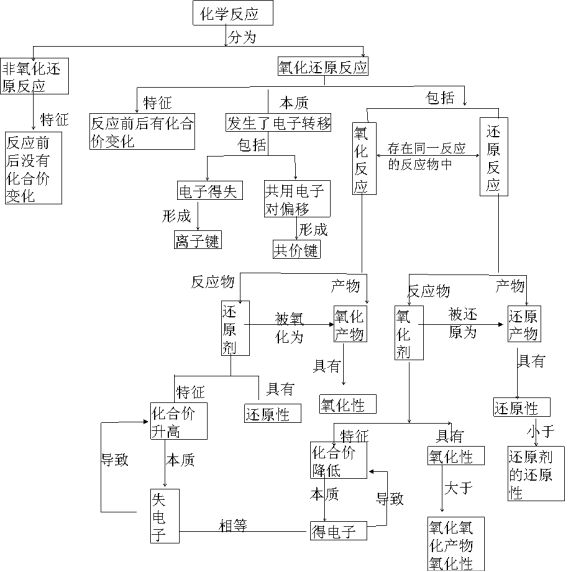
一、氧化还原反应“正说”
狭义涵义 | 广义涵义 | 本质涵义 | |
氧化反应 | 得到氧的反应 | 元素化合价升高的反应 | 失去电子的反应 |
还原反应 | 失去氧的反应 | 元素化合价降低的反应 | 得到电子的反应 |
氧化还原反应 | 发生了氧的得失的反应 | 有元素化合价升降的化学反应 | 有电子转移(得失或偏移)的反应 |
二、氧化还原反应“歪说”
1.“剂”与“性”和关系
干燥剂——具有干燥性——将湿气体干燥——本身被湿物质湿润
氧化剂——有氧化性——可将还原剂氧化——本身被还原剂还原
还原剂——有还原性——可将氧化剂还原——本身被氧化剂氧化
它们是“一样一样的”
2、化合价与电子得失的关系——荣誉与利益的关系
电子是一种实实在在存在的物质,得电子就相当于得到利益。化合价是人为给的荣誉。利益和荣誉,总是相反的。获得利益(得电子)——荣誉下降(化合价降低),东于奉献(失电子)——荣誉上升(化合价升高)。
3、氧化还原性强弱的关系
现有一伙小朋友在玩球:
抢球的能力:无球的张三>有球的李四。
失球的可能性:无球的张三<有球的李四。
现在球在李四手里(有球的李四),无球张三来了,那么就出现了如下结果:

如果碰到抢球水平更高的,则可以从有球的张三手里把球抢走,而无球的李四,则可去抢水平更差的人手里的球。
在氧化还原反应中,2I-+ Cl2= I2+2Cl‑
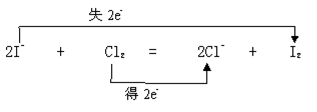
这里I-(还原剂)就相当于是有球的李四,Cl2(氧化剂)就相当于无球的张三,I2(氧化产物)相当于无球的李四,他失去了电子,不甘心,有再得到电子的欲望(氧化性),但是得碰到还原性更强的物质才行。Cl-(氧化产物)相当于有球的张三,他有失去电子的可能,有还原性。但是要碰到氧化性更强的氧化剂才行。
高锰酸根的氧化性比Cl2更强,于是:
MnO4-+H++Cl-→Mn2++Cl2↑+H2O
S2-更差劲,更守不住电子,还原性比I-更强,或者说,S的氧化性比I2更弱,抢电子能力更差。于是下列反应可以发生:S2-+ I2= S + 2I‑
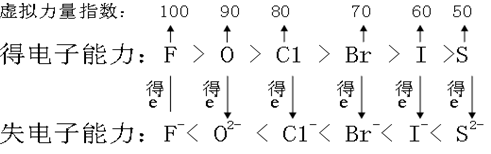
如果我们将氧化剂氧化能力,给一个力量指数,力量指数越大的,得电子能力越强,氧化性越强。如:F、O、Cl、Br、I、S为例:

- 全部评论(0)
