热点物质:解读高考新宠—高铁酸钾
时间:2020-03-05 18:43 来源:未知 作者:陈儒生 点击:次 所属专题: 高铁酸盐
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
高铁酸钾于1702年发现并报道于世。至今已制 备出了多种碱金属、碱土金属和过渡金属的高铁酸 盐,这类化合物可用于替代二氧化锰作干电池的电 极材料、作为有机化学反应的选择性氧化剂和用于 制备磁记忆材料等。近年来,我国研究较多的是高 铁酸盐化合物在水处理方面的应用,这是由于高铁 酸钾对含有腐殖质的水的消毒过程不会产生有致癌 作用的三卤甲烷(THM),生成的Fe3+、Fe(OH)3胶体对 水中的悬浮物、有机和无机污染物均具有凝聚、吸 附和沉淀的作用,净水效果非常明显,也不会造成 二次污染。因此,高铁酸钾是一种新型、高效、 广谱水处理剂,应用前景非常广阔。
1、结构
FeO42-的结构式如下:
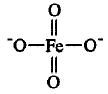
其中,FeO42-中的四个铁氧键基本相同,Fe原子具有正四面体结构。构成高铁酸钾晶胞的基本结 构单元是FeO42-,每个晶胞中含有4个K2FeO4 “分 子”。
2、物理性质
纯高铁酸钾是具有紫黑色光泽的细微结晶粉 末,含杂质(如KCl、KOH)的高铁酸钾呈灰黑色。干 燥的高铁酸钾在198℃以下是稳定的,它极易溶于水而形成类似高锰酸钾的紫红色溶液。
3、化学性质
(1) 不稳定性
高铁酸钾仅在浓碱溶液中能暂时存在,稀释时 便会逐渐分解放出氧气。
(2) 强氧化性
Fe(III)作为还原剂时的标准电极电势如下:
FeO42-+8H++3e- = Fe3++4H2O 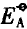 =2.2V
=2.2V
FeO42 +4H2O+3e- = Fe(OH)3+5OH- 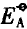 =0.72V
=0.72V
从电极电势可以看出,在酸性介质中FeO42-是 一个强氧化剂,一般的氧化剂很难把Fe3+氧化成 FeO42-;相反,在碱性介质中,Fe(III)却能被一些氧化剂如NaClO所氧化。
高铁酸钾是比KMnO4、O3、Cl2、ClO2等氧化性更强的氧化剂。在碱性和中性环境下,其水溶液可氧化水而自身分解
4FeO42-+4H2O=2Fe2O3+8OH-+3O2
2FeO42-+5H2O=2Fe(OH)3+4OH-+3/2O2
高铁酸钾在酸性介质中的氧化性强于碱性介质,且迅速分解而生成 Fe3+; 2FeO42-+ 10H+=2Fe3++3/2O2+5H2O
4、制备方法
目前,制备高铁酸钾的方法很多。主要有以下 三种:干法、湿法、电解法
(1) 干法
该法是将固态铁的化合物与氧化剂及其他反应 物混合并加热共融,可以得到高铁酸盐。如将 Fe2O3、KNO3、KOH混合并加热共融,可以得到高铁酸钾:Fe2O3 +3KNO3 +4KOH =2K2FeO4 +3KNO2 + 2H2O;也可以用过氧化物与铁的化合物反应制备高铁酸钾,如将Na2O2和FeSO4在密闭、干燥的环境中混勻,在N2气流中加热反应,可得Na2FeO4粉末, 方程式为 2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O + 2Na2SO4+O2,产物溶于浓NaOH溶液中并进行抽 滤,在滤液中加人KOH固体至饱和就可以析出高 铁酸钾固体。
(2) 湿法
该法是在溶液中进行的反应,此法要求溶液必须是强碱性的,通常用次氯酸盐作氧化剂。首先制备次氯酸钾饱和溶液:2KOH+Cl2=KClO+KCl+H2O,再加人Fe (OH)3,合成高铁酸钾:2Fe (OH)3+3ClO- + 4OH-=2FeO42-+3Cl-+5H2O; Br2可以将 Fe (OH)3氧 化成高铁酸钾:2Fe(OH)3 + 10KOH+3Br2=2K2FeO4+6KBr+8H2O
(3)电解法
电解法通常以浓的强碱溶液为电解液,以金属 铁或者铁的化合物为起始原料,采用惰性电极,电 解生成铁的六价化合物,反应为Fe+2NaOH+2H2O= Na2FeO4+3H2,Fe+2KOH+2H2O=K2FeO4+3H2, 以金属铁为电极原料合成高铁酸钾比以三氧化二铁 为起始原料更加方便,合成方法简单,电流效率 高,而且产品监测容易进行。
5、练习
(1) (2005•江苏化学卷.14)高铁电池是一种新 型可充电电池,与普通高能电池相比,该电池能较长时间保持稳定电压。高铁电池的总反应为: 3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH, 下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH, 下列叙述不正确的是( )
A. 放电时负极反应为Zn-2e-+2OH-=Zn(OH)2
B. 充电时阳极反应为Fe(OH)3 -3e-+5OH=FeO42- +4H2O
C. 放电时每转移3mol 电子,正极有1mol K2FeO4 被氧化
D. 放电时正极附近溶液的碱性增强
解析:根据题给总反应式,髙铁电池放电时必是锌在负极失去电子,高铁酸钠在正极得到电 子。充电时,阳极上氢氧化铁转化成高铁酸钠。放 电时正极附近生成OH-离子,碱性要增强。本题考查考生运用原电池、电解等基础理论解决新情景问题的能力,试题又跟能源问题相联系,很有吸引 力。
答案:C
(2) (2007.山东理科综合.29)铁合金是金属材 料王国的霸主,亚铁盐、铁盐、髙铁酸盐等铁的重 要化合物在不同领域中个扮演着重要的角色。这些 化合物之间可以相互转化,利用转化过程中发生的 特征变化,不仅能够实现物质或能量的转化,还用 于化学的定性或定量研究。
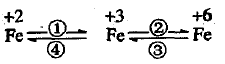
已知4FeO42-只能在强碱性介质中稳定存在,在 酸性介质或水中不稳定,如4FeO42-+20H+=4Fe3++3O2+10H2O ;4FeO42-+ 10H2O = 4Fe(OH)3+3O2+8OH-
请利用下列用品:FeCl2溶液(浅绿色)、FeCl3溶液(黄 色)、Na2FeO4溶液(紫红色)、铁粉、KSCN溶液、NaOH 溶液、NaClO溶液、盐酸、金属锌片、惰性电极(或放电 物质做电极)材料、蒸馏水及必要的实验仪器,完 成下列任务:
①设计一个实现上述转化①或者④的 实验方案(要求产物纯净),写出简要的实验步骤。
②在浓碱中,用NaClO可以实现转化②,这一 反应的离子方程式为(不必配平) 。
③一种新型高能碱性电池利用转化③将化学能 转化为电能,该电池由电解质(KOH水溶液)、 K2FeO4、金属锌及必要的填充材料构成。该电池放电时发生反应的化学方程式为 (不必配平)
④高铁酸盐是比高锰酸盐更强的氧化剂,研究证明它是一种“绿色环保高效”净水剂。目前国内 外广泛使用的含氯饮用水消毒剂(均为含氯的物 质:如漂白粉、氣气和二氧化氯等,它们具很好的杀菌效果,但不能除去水中的悬浮杂质,为了除去水中的细微悬浮物,还需另外添加絮凝剂,如聚合铝的氯化物。高铁酸盐的性能更为优良,为什么说它作为净水剂是“绿色环保髙效”的)? 。
解析:本题起点高,但是落点非常低。(1) 本小题是一道开放性试题,可以根据自己的知识储 备任意选择一种情况;(2)、(3)考查考生对氧化还原 基础知识的理解和应用能力;(4)考查考生对胶体知 识的了解及在日常生活中的应用。
答案:(1),④:在三氣化铁溶液中加入过量 的铁粉,充分反应后,过滤,滤液在氯化氢的蒸气中蒸干,可得氯化亚铁固体。
(2) 3ClO-+2Fe(OH)3+4OH-=2FeO42-+3Cl-+5H2O
(3) 2K2FeO4+3Zn+8H2O = 2Fe (OH)3+3Zn (OH)2+4KOH
(4) 该净水剂在杀菌消毒的过程中被还原为+3 价的铁,形成具有强吸附性的氢氧化铁,通过吸附 与水中的细微悬浮物共同聚沉,对环境和生命体都 不会构成危害。
(1997•上海.27)高铁酸钠(Na2FeO4)是水处理 过程中使用的一种新型净水剂,它氧化性比高锰酸 钾更强,本身在反应中被还原为Fe3+离子。
①配平制取高铁酸钠的化学方程式:_ Fe(NO3)3+__NaOH+ Cl2 =__ Na2FeO4+ NaNO3+__NaCl+ H2O;反应中______ 元素被氧化,转移电子总数为_______
②高铁酸钠之所以能净水,除了能消毒外,另 一个原因是
解析:本题考査考生配平氧化还原方程式的能 力以及对胶体知识的掌捏和应用。
答案:①根据电子转移守恒,得 2,16,3,2,6,6,8,②Na2FeO4在分解过程中生成Fe (OH)3胶体吸附水中的悬浮物,达到净化水的 目的。

- 全部评论(0)
