运用溶度积计算平衡常数解答疑难问题
时间:2019-06-12 15:45 来源:未知 作者:宴雄 点击:次 所属专题: 沉淀转化 溶度积
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
对于人教版《化学反应原理》“难溶电解质的溶解平衡”一节,学生存在疑难问题较多。主要集中在几个与溶度积相关的化学反应。而对于化学反应进行的程度最有说服力的是平衡常数的大小,运用溶度积计算出平衡常数能帮助学生解答几个疑难问题。
1、 与Mg(OH)2沉淀相关的反应
浓氨水能与MgCl2溶液反应产生Mg(OH)2沉淀,而人教版《化学反应原理》“难溶电解质的溶解平衡”一节中,Mg(OH)2 沉淀能溶于NH4Cl溶液中,看似矛盾,学生很疑惑。
已知室温时,Kb(NH3·H2O)=1.8×10-5,K [Mg(OH)2]=1.8×10-11 。要实现转化:Mg(OH)2(s)+2NH4+(aq) M2+(aq)+2NH3·H2O (aq)
M2+(aq)+2NH3·H2O (aq)
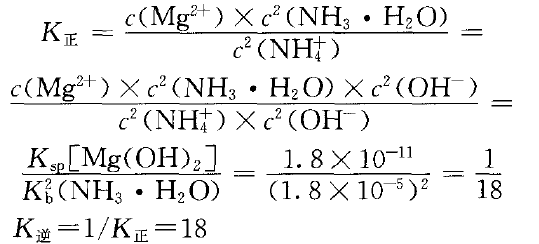
不难看出K正与K逆相差较小,说明正、逆反应的程度相当。NH4Cl溶液浓度较大时平衡正向移动,有利于Mg(OH)2沉淀的溶解。氨水浓度较大时平衡逆向移动,有利于Mg(OH)2沉淀的生成。
其他沉淀碱是否可溶于铵盐溶液呢?可以按上述过程计算出对应的K值。(见表1)
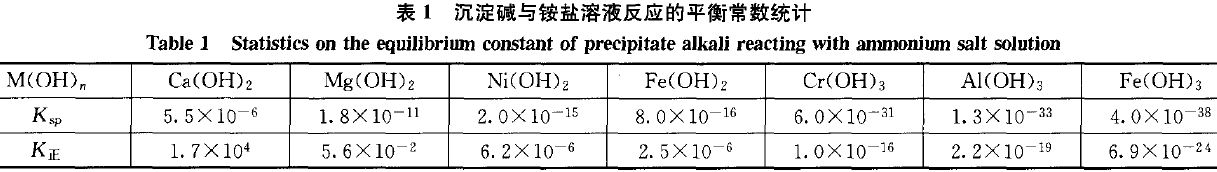
K正>1时,正反应进行较完全,沉淀碱易溶于铵盐溶液,如:Ca(OH)2;K正<1时,正反应不易发生,沉淀碱不溶于铵盐溶液,而金属阳离子M 易与氨水反应生成沉淀碱,如:Ni(OH)2,Fe(OH)2,Cr(OH)3,Al(OH)3,Fe(OH)3等;K正≈1时,正、逆反应都不完全,如:Mg(OH)2。
2、 与CuS沉淀相关的反应
FeS与稀硫酸反应用于制取H2S气体,而人教版《化学反应原理》“难溶电解质的溶解平衡” 一节中,H2S可以作Cu2+的沉淀剂生成极难溶的CuS沉淀与H+。与已有的“较强酸制较弱酸”知识点存在较大反差,都是金属硫化物,为什么会有那么大的差异呢?
已知在室温时,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1× 10-15,Ka(CuS)=6.3×10 -36,Ka(FeS)=6.0× 10-18 。
要实现下列转化:Cu2+(aq)+H2S(aq)  CuS(s)+2H+(aq) ①
CuS(s)+2H+(aq) ①
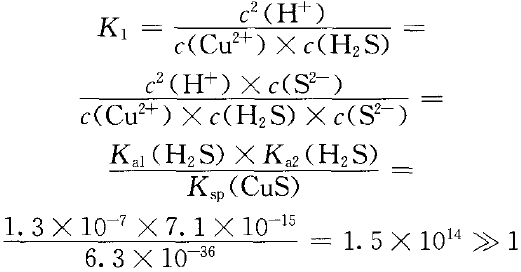
正反应程度很大,逆反应自发程度很小。即Cu2+易与H2S反应生成CuS沉淀。
同理,反应:Fe2+(aq)+H2S(aq) FeS(s)+ 2H+(aq) ②
FeS(s)+ 2H+(aq) ②
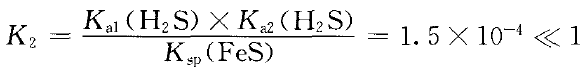
正反应进行程度很小,逆反应能自发进行。即FeS易溶于稀硫酸。
难溶硫化物的M 可否与H2S溶液反应生成硫化物沉淀?可按上述过程计算出对应的平衡常数K值。(见表2)
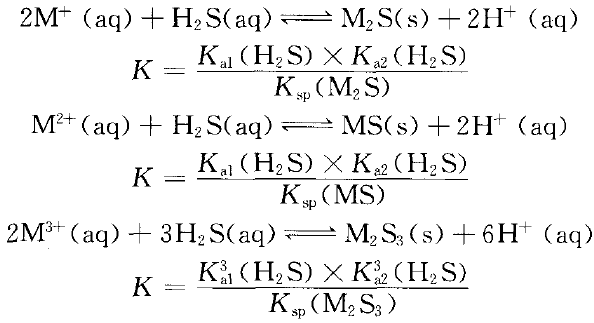

由表2中数据可以看出:M 中除Fe 不能直接和H2S溶液反应生成沉淀FeS外,其他均能和H2S溶液反应生成沉淀。难溶硫化物的主要集中在周期表Ⅷ族右侧的第四、五、六周期。
运用溶度积计算平衡常数也可以解答这样的疑问
3、 与CaCO3沉淀相关的反应
问:少量CO2与NaClO溶液反应生成NaHCO3,而复习漂白粉的漂白原理时,少量CO2与漂白粉有效成份Ca(ClO)2 反应生成的是CaCO3。这又是为什么呢?
已知室温时,Ka1(H2CO3)=4.4×10-7,Ka2(H2CO3)=4.7× 10-11 ,Ka(HClO)=3.0× 10-8 ,Ksp (CaCO3) =2.8× 10-9。
由Ka1(H2CO3)>Ka (HClO)>Ka2(H2CO3),
可以看出少量CO2与NaClO溶液发生的离子反应 是:ClO-(aq)+ H2CO3(aq) HCO3-(aq)+ HClO(aq) ①
HCO3-(aq)+ HClO(aq) ①
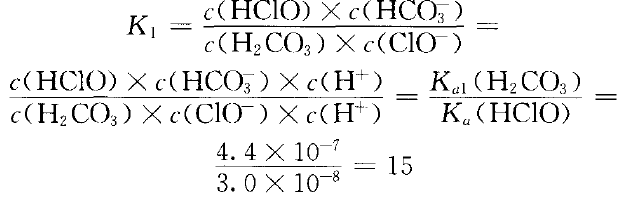
反应可以正向进行,但程度不大。HCO3- 可否进一步与NaClO溶液反应?因Ka2(HCO3- )< Ka(HClO),不可能发生:ClO- (aq)+HCO3- (aq) CO32-(aq)+HClO(aq) ②
CO32-(aq)+HClO(aq) ②
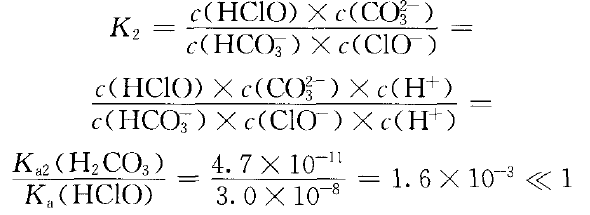
HCO3-可否进一步与Ca(ClO)2溶液反应呢? 可由反应方程式计算出反应的平衡常数从而判断:
ClO-(aq)+Ca2+(aq)+HCO3-(aq) CaCO3(s)+HClO(aq) ③
CaCO3(s)+HClO(aq) ③
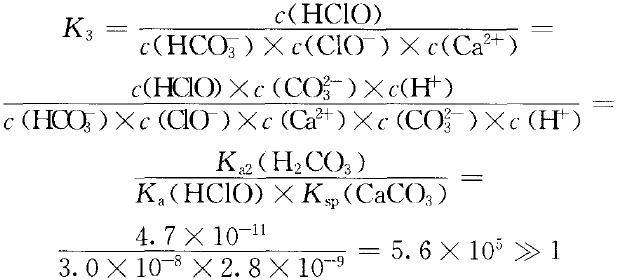
由于Ksp(CaCO3)=2.8×10-9 ,很小,HCO3-进一步与Ca(ClO)2溶液反应的主要因素是形成CaCO3沉淀,而酸的强弱只是次要因素。
反应①与反应③相加便可得知:少量CO2与 漂白粉有效成份Ca(ClO)2。反应生成的是CaCO3沉 淀,即有:
Ca2+(aq)+2ClO-(aq)+H2CO3(aq) CaCO3(s)+2HClO (aq) ④
CaCO3(s)+2HClO (aq) ④
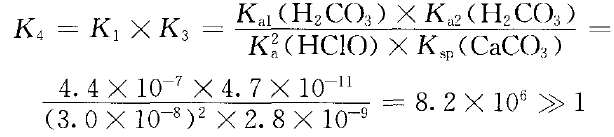
通过以上的计算与分析,让学生熟练掌握了运用溶度积计算化学平衡常数,从而判断反应能否发生;在分析解决一些实际问题时,更进一步领悟了主要矛盾与次要矛盾的辩证关系。

- 全部评论(0)
