溶液pH的计算方法
时间:2023-12-18 09:32 来源:未知 作者:化学自习室 点击: 次 所属专题: ph计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
溶液pH计算的整体思路是:根据pH的定义pH=-lgc(H+),溶液pH计算的核心是确定溶液中的c(H+)相对大小。
一、单一溶液的pH的计算
若该溶液是酸性溶液,必先确定c(H+),再进行pH的计算。若该溶液是碱性溶液,必先确定c(OH-),可根据c(H+)·c(OH-)=Kw换算成c(H+),再求pH,或引用pH定义,由c(OH-)直接求POH,再根据pH+POH=PKw,换算出pH。
例1、求室温下1.0×10-3mol/L 的Ba(OH)2溶液的pH。
解析:由题意c(OH-)=2.0×10-3mol/L,c(H+)·c(OH-)=Kw,c(H+)=Kw/ c(OH-)=5.0×10-12mol/L,pH=-lgc(H+)=-lg5·0×10-12=11.3。
或由题意c(OH-)=2.0×10-3mol/L,POH=-lgc(OH-)=-lg2·0×10-3=2.7,pH+POH=PKw,pH+2.7=14,pH=11.3。
二、溶液稀释后的pH的计算

1、强酸或强碱的稀释
在稀释强酸或强碱时,当它们的浓度大于10-5mol/L 时,不考虑水的电离;当它们的浓度小于10-5mol/L 时,应考虑水的电离。
如pH=6的盐酸,稀释100倍,稀释后pH≈7(不能大于7);pH=8的氢氧化钠溶液,稀释100倍,稀释后pH≈7(不能小于7);pH=3的盐酸,稀释100倍,稀释后pH=5;pH=10的氢氧化钠溶液,稀释100倍,稀释后pH=8。
例2、室温时将pH=5的硫酸溶液稀释1000倍后,则c(H+):c(SO42-)是( )
A. 2:1 B. 21:1 C. 20:1 D. 22:1
解析:pH=5时,c(H+)酸=1×10-5mol/L,c(SO42-)=5×10-6mol/L,稀释1000倍后,由硫酸电离出的c(H+)酸=1×10-8mol/L,c(SO42-)=5×10-9mol/L,考虑水的电离受硫酸的抑制,设水电离出的c(H+)为xmol/L,故水电离出的c(OH-)也为Xmol/L,根据水的离子积在室温时为一常量,得方程(x+10-8)·x=10-14,解得x=9.5×10-8,故c(H+):c(SO42-)=[c(H+)酸+c(H+)水]: c(SO42-)=10.5×10-8mol/L: 5×10-9mol/L=21:1,故应选B。
2、弱酸或弱碱的稀释
在稀释弱酸或弱碱过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH范围。
如pH=3的醋酸溶液,稀释100倍,稀释后3<pH<5;pH=10的氨水,稀释100倍,稀释后8<pH<10;pH=3的酸溶液,稀释100倍,稀释后3<pH≤5;pH=10的碱溶液,稀释100倍,稀释后8≤pH<10。
例3、pH=11的氨水溶液和氢氧化钠溶液,用蒸馏水稀释100倍,二者的pH的关系是( )
A.氨水的pH大于氢氧化钠的pH
B.氨水的pH小于氢氧化钠的pH
C.都比原来小
D.氨水比原来的大,氢氧化钠比原来的小
解析:氨水为弱碱,氢氧化钠为强碱,稀释100倍之后,氨水的9<pH<11,而氢氧化钠溶液的pH=9。故选A、C。
三、溶液混合后的pH的计算
两种溶液混合后,首先应考虑是否发生化学变化,其次考虑溶液总体积变化,一般来说溶液的体积没有加和性,但稀溶液混合时,常不考虑混合后溶液的体积的变化,而取其体积之和(除非有特殊说明)。
1、两强酸混合后的pH的计算
先求混合后的c(H+)混,再直接求pH。即:c(H+)混=[ c(H+)1×V1+c(H+)2×V2]/(V1+V2)。
例4、pH=4的盐酸和pH=2的盐酸等体积混合后,溶液的pH最接近于()
A.2.0 B. 2.3 C. 3.5 D. 3.7
解析:由题意pH=4的盐酸,c(H+)1=1.0×10-4mol/L;pH=2的盐酸,c(H+)2=1.0×10-2mol/L。c(H+)混=(1.0×10-4mol/L×V +1.0×10-2mol/L×V)/2V=5.0×10-3mol/L,pH= 2.3。故应选B。
2、两强碱混合后的pH的计算
先求混合后的c(OH-)混,再间接求pH。即:c(OH-)混=[ c(OH-)1×V1+c(OH-)2×V2]/(V1+V2)。
知识拓展——0.3规则(近似规则)
若两种强酸溶液或两种强碱溶液等体积混合,且其pH相差2个或2 个以上时,混合液的pH有如下近似规律:
两强酸等体积混合时,混合液的pH=pH小+0.3;
两强碱等体积混合时,混合液的pH=pH大-0.3。
如上述例4若用0.3规则,就很方便,混合液的pH= pH小+0.3=2+0.3= 2.3。
3、强酸与强碱溶液混合后的pH的计算
根据n(H+)与N(OH-)的相对大小先判断酸、碱的过量情况。
⑴强酸与强碱恰好完全反应,溶液呈中性,pH=7。
⑵若酸过量,溶液呈酸性,n(H+)>n(OH-),c(H+)混=[ n(H+)-n(OH-)]/V(总)。
⑶若碱过量,溶液呈碱性,n(OH-)>n(H+),c(OH-)混=[ n(OH-)-n(H+)]/V(总),再求出c(H+)混。
例5、60mL0·5mol/L NaOH溶液和40mL0·4mol/L 硫酸混合后,溶液的pH最接近于( )
A. 0.5 B. 1.7 C. 2 D. 13.2
解析:由题意知,酸碱中和反应后,酸过量,c(H+)混=[ n(H+)-n(OH-)]/V(总)=(0.032mol-0.03mol)/0.1L=0.02mol/L,pH=1.7,故应选B。
⑷若未标明酸碱的强弱,混合后溶液pH不定,应分析讨论。
①若强酸(pH1)和强碱(pH2)等体积混合,pH1+pH2=14,则溶液呈中性,pH=7;pH1+pH2>14,则溶液呈碱性,pH>7;pH1+pH2<14,则溶液呈酸性,pH<7。
②若酸(pH1)和碱(pH2)等体积混合,pH1+pH2=14,若为强酸与强碱,则恰好反应,pH=7;若为弱酸与强碱,则酸有剩余,pH<7;若为强酸与弱碱,则碱有剩余,pH>7。
例6、在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是( )
A.pH=3的硝酸和pH=11的氢氧化钠溶液
B.pH=3的盐酸和pH=11的氨水
C.pH=3的硫酸和pH=11的氢氧化钠溶液
D.pH=3的醋酸和pH=11的氢氧化钠溶液
解析:A、C两选项为强酸与强碱的混合,且pH1+pH2=14,则溶液呈中性,pH=7。B选项为强酸与弱碱的混合,且pH1+pH2=14,则溶液呈碱性,pH>7。D选项为弱酸与强碱的混合,且pH1+pH2=14,则溶液呈酸性,pH<7。故应选D。
注意:在相关计算过程中,应遵守“酸按酸,碱按碱,同强混合在之间,异强混合看过量”。
溶液pH的计算方法:
总体原则
(1)若溶液为酸性,先求c(H+),再求pH;
(2)若溶液为碱性,先求c(OH-),再由Kw/c(OH-)求(H+),最后求pH。
1.单一溶液pH的计算
(1)强酸溶液,如HnA溶液,设溶质的物质的量浓度为


(2)强碱溶液,如B(OH)n溶液,设溶质的物质的量浓度为


2.两强酸混合后pH的计算
由 先求出混和后的c(H+)混,再根据公式pH=-lgc(H+)求pH。若两强酸溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH小的加0.3。如pH=3和pH=5的盐酸等体积混合后,pH=3.3。
先求出混和后的c(H+)混,再根据公式pH=-lgc(H+)求pH。若两强酸溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH小的加0.3。如pH=3和pH=5的盐酸等体积混合后,pH=3.3。
3.两强碱混合后pH的计算
由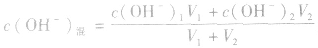 先求出混和后的c(OH-)混,再通过Kw求出混合后的c(H+),最后求pH。若两强碱溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH大的减0.3。如pH=9和pH=11的烧碱溶液等体积混合后, pH=10.7。
先求出混和后的c(OH-)混,再通过Kw求出混合后的c(H+),最后求pH。若两强碱溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH大的减0.3。如pH=9和pH=11的烧碱溶液等体积混合后, pH=10.7。
4.强酸与强碱混合后pH的计算
强酸与强碱混合的实质是中和反应即H++OH-=H2O中和后溶液的pH有以下几种情况:
(1)若恰好中和,pH=7。
(2)若剩余酸,先求中和后的c(H+),再求pH。
(3)若剩余碱,先求中和后的c(OH-),再通过Kw求出c(H+),最后求pH.
注意:强酸与强碱等体积混合后溶液酸碱性的判断规律:
①若二者pH之和为14,则混合后的溶液呈中性, pH=7
②若二者pH之和大于14,则混合后的溶液呈碱性
③若二者pH之和小于14,则混合后的溶液呈酸性,
5.溶液稀释后求pH
(1)对于强酸溶液,每稀释10倍体积,pH增大1 个单位;对于弱酸溶液,每稀释10倍体积,pH增大不足一个单位。无论稀释多少倍,酸溶液的pH不能等于或大于7,只能趋近于7。
(2)对于强碱溶液,每稀释10倍体积,pH减小1 个单位;对于弱碱溶液,每稀释10倍体积,pH减小不足一个单位。无论稀释多少倍,碱溶液的pH不能等于或小于7,只能趋近于7。
例如:pH=6的HCl溶液稀释100倍,溶液pH≈7 (不能大于7);
pH=8的NaOH溶液稀释100倍,溶液pH≈7(不能小于7):
pH=3的HCl溶液稀释100倍,溶液pH=5;
pH=10的NaOH溶液稀释100倍,溶液pH=8。
注意:弱酸、弱碱的稀释:在稀释过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH范同。
例如:pH=3的CH3COOH溶液稀释100倍,稀释后3<pH<5
pH=10的NH3·H2O溶液稀释100倍,稀释后8<pH<10
pH=3的酸溶液稀释100倍,稀释后3<pH≤510
pH=10的碱溶液稀释100倍,稀释后8≤pH<10

- 全部评论(0)
