各种典型晶体中配位数的判断
时间:2022-04-06 17:28 来源:未知 作者:化学自习室 点击:次 所属专题: 晶胞配位数
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.最密堆积晶体的配位数均为12。
如金属晶体中的两种最密堆积:面心立方最密堆积A1、六方最密堆积A3。
面心立方最密堆积A1(如图所示),
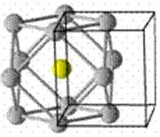
典型代表Cu、Ag、Au,因周围的原子都与该原子形成金属键,以立方体的面心原子分析,上、中、下层各有4个配位原子,故配位数为12。
六方最密堆积A3(如图所示),
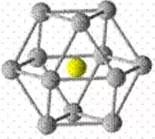
典型代表Mg、Zn、Ti,因周围的原子都与该原子形成金属键,以六方晶胞的面心原子分析,上、中、下层分别有3、6、3个配位原子,故配位数为12。
又如分子晶体中的干冰(如下图所示),
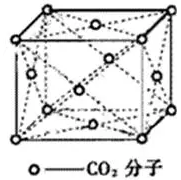
以立方体的面心CO2分子分析,上、中、下层各有4个CO2分子,故配位数为12。
2.体心立方堆积晶体的配位数为8。
如金属晶体中的体心立方堆积A2(如图所示),
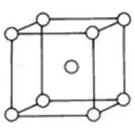
典型代表Na、K、Fe,因立方体8个顶点的原子都与体心原子形成金属键,故配位数为8。
又如CsCl型离子晶体(如下所示),
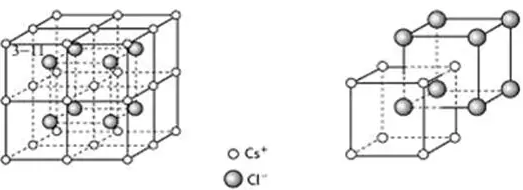
CsCl晶体中,每个离子被处在立方体8个顶点带相反电荷的离子包围,Cl-离子和Cs+离子的配位数都为8。或以大立方体的面心Cs+离子分析,上、下层各有4个Cl-离子,配位数为8。
注意:每个Cl-(Cs+)离子周围等距且紧邻的Cl-(Cs+)在上下、左右、前后各2个,共6个,这不是真正的配位数。因为是同电性离子。
3.面心立方堆积晶体的配位数为6。
如NaCl型离子晶体(如下所示),
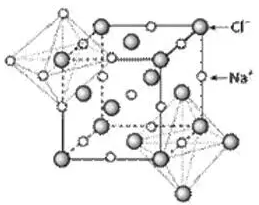
NaCl晶体中,每个离子被处在正八面体6个顶点带相反电荷的离子包围,Cl-离子和Na+离子的配位数都为6。
注意:每个Cl-(Na+)离子周围等距且紧邻的Cl-(Na+)在上、中、下层4个,共12个,这不是真正的配位数。因为是同电性离子。
又如金属晶体中的简单立方堆积(如图所示),
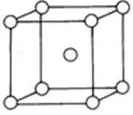
PO晶体中,立方体位于1个顶点原子的上下、前后、左右各有2个原子与其形成金属键,配位数为6。
4.配位数为4的几种晶体。
如ZnS型离子晶体(如下图所示),
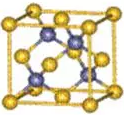
ZnS晶体中的S2-离子和Zn2+离子排列类似NaCl型,但相互穿插的位置不同,使S2-、Zn2+离子的配位数不是6,而是4。具体可将图示中分为8个小立方体,其中体心有4个S2-离子,每个S2-离子处于Zn2+离子围成的正四面体中心,故S2-离子的配位数是4。以大立方体的面心Zn2+离子分析,上、下层各有2个S2-离子,故Zn2+离子的配位数为4。Zn2+离子的配位数不易观察,亦可利用ZnS的化学式中的离子比为1∶1,推知Zn2+离子的配位数为4。
又如金刚石、碳化硅等原子晶体(如图所示),
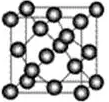
与ZnS型离子晶体类似情况,配位数均为4。二氧化硅原子晶体中,Si与O原子形成的是硅氧四面体(图示略),Si的配位数为4,而SiO2的原子比为1∶2,故O的配位数是2。
再如CaF2型离子晶体(如下图所示),
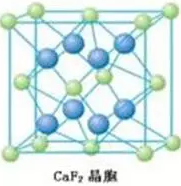
F-和Ca2+离子的配位数分别4和8。具体分析:每个F-离子处于Ca2+离子围成的正四面体中心,故F-离子的配位数是4。以大立方体的面心Ca2+离子分析,上、下层各有4个F-离子,故Ca2+离子的配位数为8。亦可利用CaF2的化学式中的离子比为1∶2,推知Ca2+离子的配位数是8。
还如在砷化镓晶胞结构(如图所示),
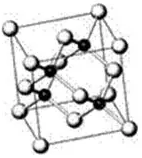
小黑点为镓原子,其配位数为4,砷化镓原子比为1∶1,故As原子的配位数也是4。
5.配位数为3的层状晶体。
如石墨或六方氮化硼等(图示略)。
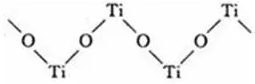
6.链状结构的配位数为2。
如硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示。Ti、O原子的配位数均为2。
注意:由于晶体结构对称性关系,晶体中不可能有11、10、9、7、5的配位数。晶体中最高配位数为12。

- 全部评论(0)
(945899432) 评论 各种典型晶体中配位数的判:感谢啊,谢谢老师
(2962402613) 评论 各种典型晶体中配位数的判:太感谢了,谢谢老师
(1018376528) 评论 各种典型晶体中配位数的判:谢谢老师的讲解!
