第十四讲:有机物的化学性质(一)常见的有机物的化学反应类型及
时间:2021-05-27 10:31 来源:高中化学教学研究 作者:张德金 点击: 次 所属专题: 有机反应类型 有机物化学性质
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
有机物除了用来食用,用作燃料,用作家具材料,用作中药材,还有很多新用途。当今社会,有机物已经和金属材料、无机非金属材料一样,应用到和材料相关的各个领域。有机物也已经应用到维护生命健康,维持食品供应的各个领域,像医药、农业、畜牧业等。
1、有机反应与无机反应有一些相似的地方
如果能学明白无机物的化学性质,学明白有机物并不难,两者有很多相似的地方。比如
①无机物FeCl3有复分解反应:FeCl3+3NaOH=Fe(OH)3+3NaCl。
有机物CH3CH2Cl有取代反应:CH3CH2Cl+NaOH→水Δ→CH3CH2OH+NaCl。
②无机物CaO有化合反应:CaO+H2O=Ca(OH)2。
有机物CH2=CH2有加成反应:CH2=CH2+H2O→催化剂→CH3CH2OH。
③无机物Fe(OH)3有分解反应:2Fe(OH)3=Δ= Fe2O3+3H2O。
有机物CH3CH2OH有消去反应:CH3CH2OH→浓硫酸170℃→C2H4↑+H2O。
④无机物SO2有氧化反应:2SO2+O2⇌催化剂Δ⇌2SO3。
有机物CH3CHO有氧化反应:2CH3CHO+O2→催化剂Δ→ 2 CH3COOH。
⑤无机物CuO有还原反应:CuO+H2=Δ= Cu+H2O。
有机物CH3CHO有还原反应:CH3CHO+H2→催化剂Δ→CH3CH2OH。
2、有机物常见的反应类型有哪些
首先注意的是,有机物也能发生一些和无机物一样的反应。
比如,燃烧反应,置换反应,有机酸、有机碱、有机盐的复分解反应,一些氧化还原反应、一些分解反应等。
本讲座列举的反应类型主要是强调有机物经过反应,变为另一种有机物的一些反应。像取代反应、加成反应、消去反应、氧化反应、还原反应、聚合反应等反应类型。(这些反应类型,也不是有机物特有的)(反应类型的定义采用的是高中教材中的定义)
(1)取代反应:有机物分子中的某些原子或原子团被其它原子或原子团所替代的反应。
通式为:

①烷与卤素单质的取代:CH4+Cl2→光照→CH3Cl+HCl
②芳香烃与溴的取代:![]() +Br2→FeBr3→
+Br2→FeBr3→![]() -Br+HBr
-Br+HBr
③芳香烃与硝酸的硝化: +HNO3→浓H2SO4Δ→
+HNO3→浓H2SO4Δ→![]() -NO2+H2O
-NO2+H2O
④卤代烃的水解:CH3CH2Br+NaOH→水Δ→CH3CH2OH+NaBr
⑤酸和醇的酯化:CH3COOH+CH3CH2OH⇌浓硫酸Δ⇌CH3COOCH2CH3+H2O
⑥酯的水解:CH3COOCH2CH3+NaOH→Δ→ CH3COONa+CH3CH2OH
取代反应与无机物的复分解反应最大的区别是,取代反应可以和单质反应。
取代反应中的与单质的反应,在有机反应中,也不叫氧化还原反应。
(2)加成反应:有机物中不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应。
通式为:
 或
或
①烯的加成:CH2=CH2+Br2→CH2BrCH2Br
②炔的加成:CH≡CH+Br2→CHBr=CHBr
③芳香烃中苯环的加成:![]() +3H2→催化剂Δ→
+3H2→催化剂Δ→![]()
④醛的加成:CH3CHO+H2→催化剂Δ→CH3CH2OH
⑤氰基的加成:R-CN+2H2→催化剂Δ→R-CH2-NH2
只要有双键或三键存在,就有可能会发生加成反应。
(3)消去反应:有机物在一定的条件下,从一个分子中脱去一个或几个小分子(如水、Hx等),生成含不饱和键化合物的反应。
通式为:

①卤代烃的消去:CH3CH2Br+NaOH→乙醇Δ→CH2=CH2↑+NaBr+H2O
②醇的消去:CH3CH2OH→浓硫酸170℃→CH2=CH2↑+H2O
③烷的分解反应:C4H10→催化剂加热加压→C2H6+C2H4
有些大分子的有机物,分解为小分子的有机物时,常常发生消去反应。
(4)聚合反应:由相对分子质量小的化合物分子互相结合成相对分子质量大的聚合物的反应,分为加成聚合反应(加聚反应)和缩合聚合反应(缩聚反应)。

①加聚反应:nCH2=CH2→催化剂→-[-CH2-CH2-]n-
②缩聚反应:nHOOCH2CH2OH+ nHOOC-COOH→催化剂→H-[-OCH2CH2O-OC-CO-]n-OH+(2n-1) H2O
带有双键或三键的有机物,可能会发生加聚反应。带有多个相互反应的原子或原子团的有机物,可能会发生缩聚反应。
(5)氧化反应:有机物分子中失去H或加入O的反应。
①醇被氧化为醛:2CH3CH2OH+O2→CuΔ→2CH3CHO+2H2O
②醛被氧化为酸:2CH3CHO+O2→催化剂Δ→2CH3COOH
③甲苯被氧化为苯甲酸:
5![]() -CH3+6KMnO4+9H2SO4→5
-CH3+6KMnO4+9H2SO4→5![]() -COOH+3K2SO4+6MnSO4+14H2O
-COOH+3K2SO4+6MnSO4+14H2O
(6)还原反应:有机物分子中加入H或失去O的反应。
①醛被还原为醇:CH3CHO+H2→催化剂Δ→CH3CH2OH
②酸被还原为醇:2CH3COOH+NaBh4→高温高压催化剂→2CH3CH2OH+NaBO2
有机物的氧化反应、还原反应,与无机物的氧化还原反应是有区别的,它们特指的是H和O的得失的反应。
若有机物中同时加H加O或去H去O,不一定是氧化反应或还原反应。
3、结构相似的有机物会发生相似的反应
如同无机物的反应中所有的可溶性碳酸盐,与所有的可溶性钙盐,在水溶液中会生成CaCO3沉淀一样。
有机物也会有相似的反应现象。比如,乙烯与溴的反应:CH2=CH2+Br2→CH2BrCH2Br。
这个反应不是特指乙烯能与Br2发生加成反应,而是指各种烯烃能与一些卤素单质之间发生加成反应。例如,丙烯和氯气也能发生反应:
CH3-CH=CH2+Cl2→CH3-CHCl-CH2Cl
所以在上一部分反应类型中的每一个反应,都是指一些结构相似的有机物的一些共同的化学性质。
那么什么样的有机物结构相似呢?下面引入两个概念:
(1)官能团:决定有机物特殊性质的原子或原子团。这个特殊性质是区别于烷之外的化学性质。

烷是有机物中的基础物质,烷中没有官能团。甲烷与卤素单质取代反应,就不是特殊化学性质。
乙烯中的碳碳双键是一种官能团,所以乙烯具有与甲烷不同的加成反应、加聚反应的化学性质,这些性质就是特殊的化学性质。
就如同所有的可溶性碳酸盐在水溶液中会和可溶性钙盐生成CaCO3沉淀一样,所有的带碳碳双键的有机物会发生加成反应、加聚反应。
(2)同系物:结构相似,在分子组成上相差一个或若干个CH2原子团的化合物互称为同系物。
烷烃,就是包括甲烷的所有同系物,都具有和甲烷相似的结构和化学性质。
烯烃,就是包括乙烯的所有同系物,分子结构中都有碳碳双键,都具有和乙烯相似的结构和化学性质。
所以,有机物中的同系物,有相似的结构(或官能团),就有相似的化学性质。
CH3CH2CH2OH(丙醇)和CH3CH2OH(乙醇)一样,也会发生消去反应,酯化反应,氧化反应等。
即使不是同系物,只要带有相同的官能团,也会有相似的化学性质。
如CH2=CHCH2CH2OH,既和CH3CH2OH一样,有消去反应、酯化反应、氧化反应等。也和CH2=CH2一样,有加成反应、加聚反应等。

4、知道有机物的结构是理解有机化学反应原因的重要基础
就像理解复分解反应中的强酸制弱酸必须有强一点的酸和弱酸盐的阴离子一样,有机物的各种反应也有结构上的原因。
知道有机物的结构是理解有机化学反应原因的重要基础。
养成用结构简式写方程式的习惯,有助于慢慢记住不同有机物的不同结构,逐渐理解反应的道理和原因。
用准确的定位和思考去理解各种有机反应在结构上的原因。(下面的每一项要仔细体会)
①甲烷的取代反应的实质是因为周围有4个单键的C上的H所具有的性质。

所以甲苯的甲基上的H有和烷一样的化学性质。
![]() -CH3+Cl2→光照→
-CH3+Cl2→光照→![]() -CH2Cl+HCl
-CH2Cl+HCl
②烯的加成反应的实质是因为两个C之间双键中的第二个键(π键)不稳定,易断键,而导致的。(在选修三中有详细解释)

炔的两个C之间三键中有两个π键,所以也不稳定,而且能发生两次加成反应。
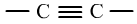
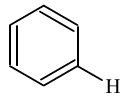
③芳香烃的取代反应是因为苯环上的H所具有的性质,芳香烃的加成反应是因为苯环上的不饱和的碳碳键所具有的性质。
④卤代烃的水解反应是-X(卤素原子)具有的性质,而卤代烃的消去反应是卤素原子和所连碳的相邻碳上的H一起具有的性质。
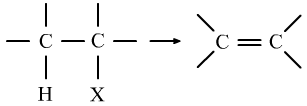
⑤醇的氧化反应是—OH和所连碳上的H一起具有的性质。
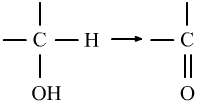
醇的消去反应与卤代烃类似,是—OH和所连碳的相邻碳上的H一起具有的性质。
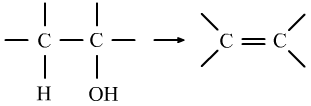
⑥醛的氧化反应是醛基上的H的性质。
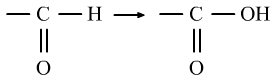
醛的还原反应是醛基上的碳氧双键中的π键的性质。(与H2的加成)
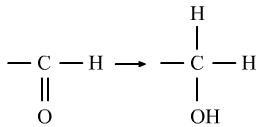
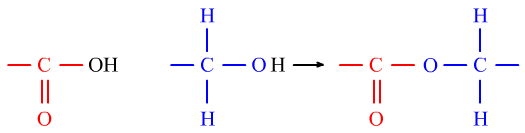
⑦酯化反应是酸的羧基上的—OH与醇的—OH上的H的性质。
5、反应类型的组合问题
同无机反应中的NH4HCO3与NaOH反应一样,有机反应也存在着多种反应类型的组合问题。
ClCH2COOCH2CH3与NaOH溶液反应时,也会存在卤代烃的水解和酯的水解的组合:
ClCH2COOCH2CH3+2NaOH→Δ→HOOCH2COONa+CH3CH2OH+NaCl
青蒿素的合成流程

【练习】
1、写出下列反应(注意书写反应条件)
(1)一分子的乙烷和一分子的氯气的反应: 。
(2)CH3CH=CHCH3与HCl的反应: 。
(3)CH3C≡CH与溴的反应: 。
(4)苯与硝酸的反应: 。
(5)CH3Cl与NaOH溶液的反应: 。
(6)CH3CHClCH3与NaOH的乙醇溶液的反应: 。
(7)CH3CH2CH2OH与HCOOH的反应: 。
(8)CH3CH2CH2OH的消去反应: 。
(9)CH3CH2CH2OH与氧气的反应: 。
(10)CH3CH2CHO与氧气的反应: 。
(11)CH3CH2CHO与氢气的反应: 。
2、写出下列反应的反应类型。
(1)CH3CH=CH2+Cl2→500℃→ClCH2CH=CH2+HCl: 。
(2)CH3CH=CH2+Cl2→CH3CHClCH2Cl: 。
(3)![]() -CH3+3H2→催化剂Δ→
-CH3+3H2→催化剂Δ→![]() -CH3: 。
-CH3: 。
(4)![]() -CH3+Br2→FeBr3→Br-
-CH3+Br2→FeBr3→Br-![]() -CH3+HBr: 。
-CH3+HBr: 。
(5)CH3CH2CH2Cl+NaOH→水Δ→CH3CH2CH2OH+NaCl: 。
(6)CH3CH2CH2Cl+NaOH→乙醇Δ→CH3CH=CH2↑+NaCl+H2O: 。
(7)CH3CH2COOH+CH3OH⇌浓硫酸Δ⇌CH3CH2COOCH3+H2O: 。
(8)CH3CHOHCH3→浓H2SO4→CH3CH=CH2↑+H2O: 。
(9)CH3CHOHCH3+O2→CuΔ→2CH3COCH3+2H2O: 。
(10)HCHO+H2→催化剂Δ→CH3OH: 。
【练习答案】
1、(1)CH3CH3+Cl2→光照→CH3CH2Cl+HCl。
(2)CH3CH=CHCH3+HCl→催化剂Δ→CH3CH2CHClCH3。
(3)CH3C≡CH+Br2→CH3cBr=CHBr或CH3C≡CH+2Br2→CH3cBr2CHBr2
(4)![]() +HNO3→浓H2SO4Δ→
+HNO3→浓H2SO4Δ→![]() -NO2+H2O。
-NO2+H2O。
(5)CH3Cl+NaOH→水Δ→CH3OH+NaCl。
(6)CH3CHClCH3+NaOH→乙醇Δ→CH3CH=CH2↑+NaCl+H2O。
(7)CH3CH2CH2OH+HCOOH⇌浓硫酸Δ⇌HCOOCH2CH2CH3+H2O。
(8)CH3CH2CH2OH→浓H2SO4→CH3CH=CH2↑+H2O。
(9)2CH3CH2CH2OH+O2→CuΔ→2CH3CH2CHO+2H2O。
(10)2CH3CH2CHO+O2→催化剂Δ→2CH3CH2COOH。
(11)CH3CH2CHO+H2→催化剂Δ→CH3CH2CH2OH。
2、(1)取代反应。(2)加成反应。(3)加成反应。(4)取代反应。(5)取代反应。(水解反应) (6)消去反应。(7)取代反应。(酯化反应)
(8)消去反应。(9)氧化反应。(10)还原反应。(加成反应)

- 全部评论(0)
