答题规范:实验中“冰水浴”的原因解释
时间:2022-04-07 08:53 来源:未知 作者:化学自习室 点击: 次 所属专题: 实验简答题 冷却
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.亚氯酸钠(NaClO2)是一种高效含氯消毒剂和漂白剂,主要用于自来水、污水等水环境的杀菌消毒,也常用作纸浆、砂糖、油脂的漂白剂。图为目前生产亚氯酸钠的流程之一(夹持装置省略),所得NaClO2具有纯度高的优点。

已知:NaClO2饱和溶液在低于38℃时会析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
C装置采用“冰水浴”的目的是______________。
2.二氧化氯(ClO2)是黄绿色易溶于水的气体,熔点为-59℃、沸点为11℃,但其浓度过高时易发生分解,因此常将其制成NaClO2固体便于运输和贮存。实验室中用过氧化氢法将ClO2制备成NaClO2固体,其实验装置如图所示。

已知:
仪器A中发生的反应:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O;
过氧化氢法制备NaClO2的原理:2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O。
冰水浴冷却的目的是______________;
3.实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2,原理为SO2(g)+Cl2(g)⇌SO2Cl2(l) ΔH=-97.3kJ/mol。装置如图所示(部分装置已省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法正确的是
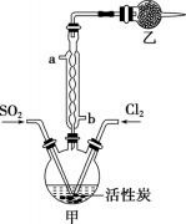
A.乙中盛放的试剂为无水氯化钙
B.制备过程中需要将装置甲置于冰水浴中
C.用来冷却的水应该从a口入,b口出
D.可用硝酸与亚硫酸钠反应制备二氧化硫
4.四溴化碳是一种灰白色粉末,熔点为94~95℃,广泛用于有机化合物的溴代、农药的制备等。某合作学习小组的同学拟用丙酮和液溴制备四溴化碳,其原理为
CH3COCH3+4Br2+5NaOH——CBr4+CH3COONa+4NaBr+4H2O。回答下列问题:
Ⅰ.制取Br2:甲组同学拟用溴化钠、二氧化锰及浓硫酸制备液溴,其实验装置如图1所示。

冰水的作用是__________。
Ⅱ.制取CBr4:乙组同学拟利用甲组同学制得的液溴与CH3COCH3(沸点56.5℃)等试剂制取四溴化碳。实验步骤如下:
步骤1:向图2中三颈烧瓶中加入11.4g NaOH和46mL 水,搅拌。
步骤2:冰水浴冷却至2℃时,开始不断滴加液溴20g,滴加完毕后在5℃下保持20min。
步骤3:加入少量相转移试剂,在不断搅拌下滴入1.6g 丙酮,维持温度在5~10℃,连续搅拌4H。
步骤4:过滤、冷水洗涤、减压烘干,得产品8.3g。
其中步骤2滴入Br2之前,冷却至2℃的目的是____________。
答案:
1.由已知信息可知,NaClO2饱和溶液在低于38C时会析出NaClO·3H2O,高于38C时析出NaClO,高于60℃时NaClO2分解成NaClO3和NaCl,同时H2O2受热易分解,故C装置采用“冰水浴”的目的是防止温度过高,NaClO2分解成NaClO3和NaCl,同时,H2O2受热易分解,
故答案为:防止温度过高,NaClO2分解成NaClO3和NaCl,同时,H2O2受热易分解;
2.减少双氧水分解(或减少ClO2的挥发或提高ClO2的溶解度)
3.B
解析:选B。SO2Cl2的熔、沸点低,易挥发,根据装置图可知,三颈烧瓶上方的冷凝管的作用是使挥发的产物冷凝回流,由于会有一部分SO2和Cl2通过冷凝管逸出,SO2和Cl2都会污染空气,故乙装置应使用碱性试剂,SO2Cl2遇水能发生剧烈反应并产生白雾,乙中盛放碱石灰,吸收未反应完的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止水蒸气进入甲中导致SO2Cl2水解。A.由上述分析可知,乙中盛放的试剂应该是碱石灰,无水氯化钙只能吸收水,A选项错误;B.根据题目中热化学方程式可知,ΔH<0,则该反应为放热反应,降低温度使平衡正向移动,有利于提高SO2C2L的产率,B选项正确;C.冷凝水应从冷凝管的下口进,上口出,故用来冷却的水应该从b口入,a口出,C选项错误;D.硝酸具有氧化性,能把二氧化硫氧化成硫酸,故不可用硝酸与亚硫酸钠反应制备二氧化硫,D选项错误。
4.冷凝溴蒸气;防止液溴挥发。

- 全部评论(0)
