各种冷凝方式总结
时间:2023-08-13 09:16 来源:未知 作者:化学自习室 点击:次 所属专题: 冷却 冷凝管
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、U型冷凝管
1.适用范围
该方法适合冷凝易升华或沸点较低的气体。冷却剂为液体,常见有水、冰水、冰盐水等。
2.实验仪器

3.使用范围
(1)证明实验室二氧化硫催化氧化装置中出来的混合气体中除了有SO2、O2气体外还有SO₃气体时,就可将混合气通过图3或图4装置,当U型管或试管的底部出现固体时,就能证明SO₃的存在。
(2)在证明石油催化裂化时能产生汽油的实验中,可将催化装置中产生的气体通过图1或图2装置,当U型管或试管的底部出现液体(可闻到汽油味)时,就能证明汽油的生成。
(3)如用冰水作冷却剂,烧杯中的温度是0℃;如用冰盐水作冷却剂时,烧杯中的温度低于零摄氏度(如氯化钙与冰水组成的混合物,可使体系温度降至-20℃左右)。被冷凝气体的沸点越低,所选用的冷却剂的温度应该越低。
4.注意事项
(1)用U型管做气体冷凝装置时,实验过程中产生液体或固体的量不能太多,否则会因为U型管的堵塞而影响气体的通过。
(2)如果要冷凝一些遇冷凝华的物质,如FeCl3、AlCl3等,需要将进气部分换成粗导管,以免物质凝华堵塞装置,导致压强过大引起危险。
(3)用试管作气体冷凝液装置时,通入气体时速率不易太快,否则会影响冷凝效果。
(4)不论用U型管还是试管作气体冷凝装置,U型管、试管都要尽可能多的浸入冷却剂中(如图1~图4所示),才能达到好的冷却效果。
(5)用图1~图4等装置做气体冷凝装置时,不宜连续性实验,也不宜将大量的气体冷凝为液体或固体,因为烧杯中的冷却剂的量是有限的,随着实验的进行冷却剂的温度会逐升高而降低冷凝效果。如果要连续性冷凝气体得到大量的液体的话,可使用冷凝管。
5.高考题型
【例】某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如图所示的装置。已知三氧化硫遇水生成硫酸并放出大量热,容易形成酸雾。试回答:

C装置用来收集三氧化硫,其中冰盐水的作用是冷却SO3以得到晶体
二、水冷凝管与空气冷凝管
1.冷凝管的种类
(1)直形冷凝管
多用于蒸馏操作,蒸气温度低于140℃,不可用于回流。外观特点如图,将一根空气冷凝管作为内芯,在其外面焊有一较粗的外套管(水冷管),在其外管的上下两侧分别有连接管接头,用作出水口和进水口,使用时,将靠下端的连接口以塑胶管接上水龙头,当作进水口。因为进水口处的水温较低而被蒸气加热过后的水温度较高;较热的水因密度降低会自动往上流有助于冷却水的循环。一般实验题给出图示中倾斜放置居多。


(2)球形冷凝管
一般用于反应装置,即在反应时考虑到反应物的蒸发流失而用球形冷凝管冷凝回流,使反应更彻底,来提高反应物的转化率和产物的产率。球形有利于增加冷却接触面,故冷凝面积较直形冷凝管大冷凝效率稍高,在有机制备实验中常见置于三颈烧瓶上方,图示中一般直立放置居多。


(3)蛇形冷凝管
内芯管为螺旋形,增加了玻璃管的长度,冷却面较球泡形更大。其它部分与球形相同。因为内芯管长度大,冷却面枳大,冷却的效果更好,主要用于冷凝收集沸点偏低的蒸馏产物。


(4)空气冷凝管
适用于沸点在140℃以上物质的蒸气冷却,因为温度高于140℃使用水冷凝管可能会因为温差过大导致冷凝管炸裂。为加强冷却效果可加长长度,加热控制应使蒸气上升高度在总长度的一半以下,否则蒸气容易逸出。

(5)刺形分馏柱
韦氏分馏柱,又称刺形分馏柱。柱内每隔一定距离就有一组向下倾斜的刺状物玻璃柱,各组刺状玻璃柱呈螺旋状排列的分馏管内。使用该分馏柱的优点是:仪器装配简单,操作方便,残留在分馏柱中的液体少。其缺点是:较同样长度的填充柱分流效率低,适合于分离少量且沸点差距较大的液体。若欲分离沸点相距很近的液体化合物,则必须使用精密分馏装置。

2.作用
有易挥发的液体反应物时,为了避免反应物损耗和充分利用原料,要在发生装置上设计冷凝回流装置,使该物质通过冷凝后由气态恢复为液态、从而回流并收集,实验室可通过在发生装置上安装长玻璃管或冷凝(回流)管等实现。
3.高考题型
【例1】2--硝基--1,3--苯二酚由间苯二酚先磺化,再硝化,后去磺酸基生成。原理如下:

部分物质的相关性质如下:
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 水溶性(常温) |
间苯二酚 | 110 | 白色针状晶体 | 110.7 | 易溶 |
2--硝基--1,3--苯二酚 | 155 | 桔红色针状晶体 | 87.8 | 难溶 |
制备过程如下:
第一步:磺化。称取71.5g 间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内15min(如图1)。
第二步:硝化。待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅拌15min。
第三步:蒸馏。将硝化反应混合物的稀释液转移到圆底烧瓶b中,然后用图2所示装置进行水蒸气蒸馏(水蒸气蒸馏可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的)。

请回答下列问题:
图2中,烧瓶a中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止压强过小引起倒吸;冷凝管C中可能看到的现象是冷凝管内壁有桔红色晶体析出
【例2】(2022·辽宁·二模)1-溴丁烷主要用于生产染料和香料。实验室可通过正丁醇(CH3CH2CH2CH2OH)和氢溴酸反应制得,其反应原理如下:NaBr+H2SO4+CH3CH2CH2CH2OH CH3CH2CH2CH2Br+NaHSO4+H2O,副产物有1-丁烯、正丁醚等。
CH3CH2CH2CH2Br+NaHSO4+H2O,副产物有1-丁烯、正丁醚等。
| 名称 | 相对分子质量 | 沸点/℃ | 密度/g·mL-1 | 溶解性 |
正丁醇 | 74 | 117.7 | 0.80 | 微溶于水,易溶于浓硫酸及有机溶剂 |
1-溴丁烷 | 137 | 101.6 | 1.28 | 不溶于水,易溶于醇、醚等有机溶剂 |
正丁醚 | 130 | 142.2 | 1.77 | 不溶于水,易溶于浓硫酸及有机溶剂 |
实验步骤:
(一)1-溴丁烷的合成
在10mL 三颈烧瓶中,加入2.60g(约0.025mol)研细的溴化钠,1.85mL 正丁醇并放入一粒搅拌子,安装好回流一吸气装置(图1)。加入事先混合的2.80mL 浓硫酸和2.00mL 水的混合液,搅拌,硅油浴回流Tmin,反应完毕,稍冷却后,改成蒸馏装置,蒸出粗产物。

(二)粗产物洗涤
将馏出液依次用等体积水、浓硫酸、水、饱和碳酸氢钠溶液及水洗涤后,用无水氯化钙干燥。
(三)蒸馏得纯1-溴丁烷
将干燥好的液体转入干燥的蒸馏烧瓶中,空气浴加热,收集99℃-102℃的馏分,得到1-溴丁烷1.15mL。
回答下列问题:
(1)图1冷凝管的进水口是A(填“A”或“B”),实验中使用球形冷凝管而不用直形冷凝管的原因是球形冷凝管的接触面积大,冷凝效果好
三、分水器——冷凝式的辅助装置
1.原理
主要用于有机化学实验中,分离反应生成的水,由于有机反应多是可逆反应,反应生成的水在存在于反应体系时会对反应造成一定的影响或着使反应无法进行,此时如果运用平衡移动原理,把生成的水通过与水共沸的溶剂回流把水带出来,就能使反应在原来基础上正向进行,增大反应物的转化率和产物的产率。
2.方法介绍
实验利用恒沸混合物蒸馏方法,采用分水器将反应生成的水层上面的有机层不断流回到反应瓶中,而将生成的水留在分水器中,可以随时除去除去。实验时小火加热,保持瓶内液体微沸,开始回流,控制一定实验温度待分水器已全部被水充满时表示反应已基本完成,停止加热。
所谓恒沸物,指的是当两种或多种不同成分的均相溶液,以一个特定的比例混合时,在固定的压力下,仅具有一个沸点此时这个混合物即称做恒沸物。
3.装置图示

4.装置优点
分水器的作用是把反应产生的水从反应体系中分离开来,降低产物的浓度使得平衡反应向右移动,从而提高反应的产量,起到冷凝时的辅助作用
5.高考题型
【例】(2022·安徽·二模)呋喃甲酸乙酯是一种优良的有机溶剂和有机合成的中间体,常用于合成杀虫剂和香料。其制备方法为
 +CH3CH2OH+H2O
+CH3CH2OH+H2O

可能用到的信息如下表:
| 有机物名称 | 相对分子质量 | 密度(g/cm3) | 沸点(℃) | 在水中的溶解性 |
呋喃甲酸 | 112 | 1.32 | 230 | 可溶 |
乙醇 | 46 | 0.79 | 78.5 | 易溶 |
呋喃甲酸乙酯 | 140 | 1.03 | 196 | 难溶 |
苯 | 78 | 0.88 | 80.1 | 难溶 |
实验步骤如下:
步骤1:向如图所示的装置a中加入30mL 乙醇、10mL 呋喃甲酸、0.6mL 浓硫酸、10mL 苯和2~3片碎瓷片。组装好仪器,并预先在分水器内加入一定量水,开始缓慢加热A,苯与水会形成“共沸物”(沸点65℃),加热回流1H,直至反应基本完成。

步骤2:待反应液冷却至室温后倒入分液漏斗中,依次用40mL 水、20mL 饱和Na2CO3溶液和40mL 水洗涤;分液后取油状液体,再用无水MgSO4固体处理后蒸馏,收集相应馏分,得到呋喃甲酸乙酯14.0g。
回答下列问题:
步骤1中使用分水器的目的是分离水,促使平衡正向移动,提高原料利用率;步骤1中反应基本完成的标志是分水器中不再有水生成(或分水器中水的液面不变)
三、变式应用
1.几种变式情况
(1)冷凝回流装置
由热源、热浴、烧瓶和回流冷凝管组成。将反应物质放在圆底烧瓶中,在适当的热源上或热浴中加热。直立的冷凝管夹套中自下至上通入冷水,使夹套充满水,水流速度不必很快,能保持蒸气充分冷凝即可。加热的程度也需控制,使蒸气上升的高度不超过冷凝管的1/3。



(2)回流滴加装置
有些反应在回流状态下进行得较剧烈,放热量大,如果将反应物一次投入,反应会很难控制。在这种情况下,采用带滴液漏斗的回流滴加装置将其中一种反应物慢慢滴加进去,另外根据需要用冷水或冰水或通过热源加热流。


(3)选自《有机化学实验》图示


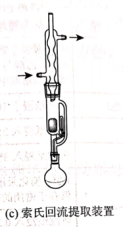



2.高考题型
【例1】化学实验小组通过查阅相关资料,设计了以下制备无水氯化亚锡(SnCl2)的实验方案:
A.将锡箔和浓盐酸(添加少量浓硝酸)装入三颈烧瓶,按下图组装好回流装置,在95℃回流反应;

B.在CO2气氛下蒸发浓缩SnCl2盐酸溶液,析出SnCl2·2H2O晶体,抽滤;
C.用乙酸酐[(CH3COO)2O]脱去结晶水,得到无水SnCl2晶体,抽滤并用乙醚洗涤,真空干燥得到产品。
已知:Sn2+具有较强还原性且易水解。
回答下列问题:
仪器A的名称是(球形)冷凝管;采用回流装置的作用:提高原料利用率、避免污染空气(答出一点即可)
【例2】无水FeCl2是重要的污水处理剂,不溶于C6H5Cl、C6H4Cl2,易溶于乙醇,易吸水和易被氧化。某实验小组利用无水FeCl3和C6H5Cl(氯苯,无色液体,沸点132℃)制备少量无水FeCl2。实验原理:2FeCl3+C6H5Cl2 FeCl2+C6H4Cl2+HCl↑,回答以下问题:
FeCl2+C6H4Cl2+HCl↑,回答以下问题:

制温度在128~139℃条件下对三颈烧瓶A加热2H,混合物颜色逐渐变浅,黏度降低。该步骤中加热温度已经接近或超过C6H5Cl沸点,但氯苯实际损失量却非常小,其原因是球形冷凝管可使挥发的氯苯冷凝回流

- 全部评论(0)
