从周期表格结构中找规律
时间:2019-02-25 09:17 来源:摘抄于因特网 作者:潘祥泰 点击:次 所属专题: 元素周期表结构
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
元素周期表的元素周期律的具体表现形式,它反映了元素之间相互联系的规律。挖掘元素周期表自身结构的内在规律,不仅能培养学生的逻辑思维能力和探究精神,而且能大大简化解题过程,提高解题速度
规律一 在周期表中,同周期第IIA与IIIA族元素的原子序数之差有以下三种情况:(1)1~3周期(短周期)元素的原子序数相差1;(2)4、5周期相差11;(3)第6、7周期相差25。
例1 A为IIA族元素,B为IIIA族元素,它们的原子序数分别为m 和n,且A,B为同周期元素,则下列关系式错误的是( )。
A。n=m+1 B. n=m+11
C. n=m+25 D. n=m+10
解析 根据规律一,选D。
规律二 每周期排布的元素种数为,若n为周期序数,则奇数周期中为(n+1)×(n+1)/2种,偶数周期中为(n+2)×(n+2)/2种。
例2.已知第1到第7周期元素的总数依次为:2,8,8,18,18,23,26(未填满)若第8期填满后,该周期最多可容纳元素——种。
解析 运用规律二,第8周期为偶数周期,可排元素总数为(8+2)×(8+2)/2=50种。
规律三 同主族相邻元素的原子序数之差有以下两种情况:
(1)第IA、IIA族,上一周期元素的原子序数+该周期元素的总数=下一周期的元素的原子序数;
(2)第IIIA到VIIA族,上一周期元素的原子序数+下一周期的总数=下一周期的原子序数。
例3 相邻的同主族元素甲和乙,甲所在周期含有m种元素,以所在的周期含有n种元素,请回答下列问题:
若甲、乙的原子序数相差m,则下列说法中正确的是( )
A.甲、乙可能位于IA族,且甲的原子序数比乙大;
B.甲、乙可能位于IA族,且甲的原子序数比乙小
C.甲、乙可能位于ⅦA族,且甲的原子序数比乙大;
解析 (1)应用规律三,若甲、乙为IA、ⅡA族元素,且甲在乙的上周期,甲序数+m=乙序数,即乙序数-甲序数=m,B正确;若甲、乙为ⅢA到ⅦA族元素,且甲在乙的下周期,乙序数+m=甲序数,即甲序-乙序数=m,C正确,故正确选项为B、C。
规律四 设主族元素族序数为a,周期序数为b,则为:
(1)a/b <1时,为金属元素,其高价氧化物为碱性氧化物,高价氧化物对应的水化物是碱;
(2)a/b>>1时,为非属元素,其高价氧化物为碱性氧化物,最高价氧化物对应的水化物是酸;
无论是同周期还是同主族元素中,a/b的值越小,元素的金属性较强,且最高价氧化物对应的水化物的碱性越强,反之,a/b的值越大,元素的非金属性较强,其最高价的氧化物对应的水化物的酸性就越强。
例4下列物质的性质比较中正确的是( )
A.酸性H2BO3>H2CO3
B.还原性HI>HBr
C. 金属性Be>Mg
D.碱性Ba(OH)2
解析 直接运用规律四,A、C、D均不正确,元素的非金属性较强,其氢化物的还原性较弱,非金属性Br>I,故其氢化物的还原性HI>HBr,,故选B。
规律五 元素周期表中除Ⅷ族元素外,元素序数为奇数(或偶数)数的元素所在的族序数及主要化合价为奇(或偶)数。
例5 x,y为短周期元素,二者能形成化合物 x2y3(x呈最高价),若y的原子序数为n,则x的原子序数不可能是( )
A。n+4 B。n+5 C。n-3 D。n-11
解析 依题知x化合价为+3,应位于ⅢA族,原子序数为奇数;y化合价为-2,在第ⅥA族,同样规律五反推,知其原子序数为偶数,n+4不可能为奇数,故答案为A。
规律六 元素周期表中金属和非金属之间有一分界线,分界线右上方的元素为非金属元素,分界线左下方的元素为金属元素(H除外),分界线两侧的元素一般既有金属性,也有非金属性。
例6 下例叙述正确的是( )
A.通常用来制农药的元素,在分界线右上方
B.制半导体材料的元素,位于分界线左下方。
C.分界线两侧的元素中,可用作催化剂或制耐高温材料
D.沿着周期表中硼、硅、砷、碲、砹跟铝、锗、锑、钋之间画一条分界线,把表中元素分成金属和非金属两个区域
解析 依规律六和所学知识,正确的为A、D。
规律七 对角线规律。沿周期表中金属与非金属分界线方向对角的两主族元素性质相似。
这一规律以第2、3周期元素间最为明显。如
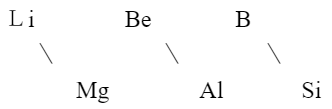
元素及对应的单质及同类化合物性质相似。
例7下列叙述不正确的是( )。
A.Be(OH)2为两性氢氧化物
B.Be与非氧化性强酸反应过都能放出H2
C.H3BO3是既能溶于水的弱酸
D.B2O3既能溶于强酸又能溶于强碱
解析 依规律七,Be与Al性质相似,Al(OH)3为两性氢氧化物Be(OH)2必为两性氢氧化物;Al与非氧化性强酸及强碱反应都能放出H2,Be也应如此;B与Si性质相似,H2SiO3是不溶于水的弱碱,H3BO3必为不溶于水的弱酸。A、B、C均正确;而B2O3性质应与SiO2相似,SiO2只能与强碱反应,并不与强酸反应故不正确的是D。
规律八 最外层电子数最大或等于3而又小于8的元素一定是主族元素;最外层电子数为1或2的元素可能是主族、负族或0族(He)元素;最外层电子数为8的元素稀有气体元素(He例外)
例8 下列元素中一定是主族元素的是( )
A.最外层电子数为1或2的元素
B.最外层电子数为3或4的元素
C.最外层电子数大于3小于8的元素
D.最外层电子数是2或8的元素
解析 根据规律八应选B、C。

- 全部评论(0)
