过氧化钠题型全面点击
时间:2016-01-18 14:18 来源: 作者:王匆雨 点击:次 所属专题: 过氧化钠
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
题型示例一:
1.Na2O2与H2O及CO2反应的的实质
解题精要:Na2O2与H20的反应实际上分两步进行
Na2O2+H2O=2NaOH+H2O2 ①
2H2O2=2H2O+O2 ↑ ②
①×2+② [消去中间产物H2O2]:
2Na2O2+4H2O=4NaOH+2H2O+O2↑
可知此反应中生成的-2价的O 进入H2O 中,而不是进入NaOH ,在标电子转移时,若用线桥表示,则左右两边的水不能消,若用单线桥表示,则左右两边的水可以消,此反应的电子转移可用下式表示:

在上述反应中Na2O2 既是氧化剂,又是还原剂,氧化产物是O2 ,还原产物是H2O。
同理Na2O2 与CO2 的反应为:
Na2O2+2H2O=2NaOH+H2O2 ① 2H2O2=2H2O+O2↑ ②2NaOH+CO2=Na2CO3+H2O ③
①×2+②+③×2[消去中间产物NaOH,H2O2 ]
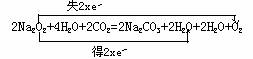
在实际教学中我们发现许多教师用双线桥表示,Na2O2与H2O,CO2反应为:
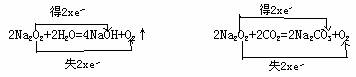
这种表示方式从化学方程式来表面看是正确的,但从反应的历程来看这反应是完全错误的。
例1:在Na2O2与H2O的反应中的还原产物是( )
A:NaOH B H2O C O2 D 无法判断
答案选B
例2:在Na2O2与CO2的反应里,每生成5.6L O2(标况)时,转移电子数为( )。
A.2个 B.0.25mol C.3.01×1023个 D.1mol
答案选C。
题型示例二:结构分析
解题精要:Na2O2的电子式为![]() ,即含有Na+和O22-(过氧离子),Na2O电子式为
,即含有Na+和O22-(过氧离子),Na2O电子式为![]() Na+,即含有Na+和O2-,同时注意:O22- 是过氧离子,而O2-是超氧离子。
Na+,即含有Na+和O2-,同时注意:O22- 是过氧离子,而O2-是超氧离子。
例3: 1mol 的Na2O2晶体和1mol 的Na2O晶体中阴离子的个数比较,前者和后者的关系是( )。
A.前者大 B.前者小 C.相等 D.不能肯定
答案选C。
题型示例三:Na2O2与H2O的反应
解题精要:利用反应方程式进行计算。通过计算可知:将Na2O2粉末加入H2O(液)中,液体增重质量等于同“分子”数的Na2O的质量。等物质的量的氧化钠和过氧化钠分别投入水中,产生氢氧化钠的物质的量相同,溶液质量增加相同。
例4:在甲、乙、丙、丁四个烧杯内分别放入0.1mol 的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL 水,搅拌,使固体完全溶解,则甲、乙、丙、丁的溶液的质量分数大小顺序是( )
A.甲<乙<丙<丁
B.丁<甲<乙=丙
C.甲=丁<乙=丙
D.丁<甲<乙<丙
解析 此题要求熟练掌握几个反应:
甲:2Na+2H2O![]() 2NaOH+H2↑
2NaOH+H2↑
乙:Na2O+H2O![]() 2NaOH
2NaOH
丙:2Na2O2+2H2O![]() 4NaOH+O2↑
4NaOH+O2↑
则其质量分数分别为:
甲:![]() =
=![]()
乙:![]() =
=![]()
丙:![]() =
= ![]()
丁:![]() =
=![]()
故答案为B.
小结:由反应方程式可知,将Na2O2粉末加入H2O(液)中,液体增重质量等于同“分子”数的Na2O的质量。等物质的量的氧化钠和过氧化钠分别投入水中,产生氢氧化钠的物质的量相同,溶液质量增加相同。
题型示例四:Na2O2与CO2的反应及其变式
例5:把4.48L CO2通过一定质量的固体Na2O2后,收集到3.36L(S.P.T.)气体,则这3.36L 气体的质量是( )。
A.3.8g B.5.6g C.4.8g D.6.0g
分析:依据差量法解此题。
2CO2+2Na2O2=2Na2CO3+O2 ΔV
2 1 1
2.24L 1.12L 1.12L(4.48-3.36)
即参加反应的CO2为2.24L,剩余CO2的体积为4.48-2.24=2.24L。生成的O2为1.12L。从而可求出气体的总质量为6.0g,所以答案选D。
变式一:Na2O2+CO+CO2题型
解题精要:2CO2+2Na2O2=2Na2CO3+O2,2CO+O2=2CO2,经电火花不断打火点燃,从总的反应效果看,最终相当于Na2O2先与CO反应并无气体生成,再与CO2反应时产生氧气体积等于原二氧化碳的体积的一半。
例6:在密闭容器中充入CO和CO2的混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内压强为P1,若控制容器的体积不变,加入足量的过氧化钠,并不断用电火花点燃至完全反应,恢复到开始的温度,再次测得容器内的压强为P2,则P1和P2关系是( )
A P1=8P2 B P1=4P2 C P1=2P2 D P1=P2
分析:m(CO、CO2)=4×8=32,可用十字交叉法求n(CO2) :n(CO)=1:3,所以:
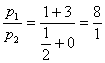 ,选A。
,选A。
例7:在标况下,将CO和CO2混合气体共0.1摩充入盛有3.9gNa2O2密闭容器中,然后用电火花不断引燃容器内气体混合物,使之充分反应。若CO2在混合气体中的物质的量分数为x,试通过分析和计算,得出x值与剩余气体的关系的几种情况,将结果填写在表1中(写计算过程)。
表1 Na2O2+CO+CO2的反应结果与各物质的量的关系
x值 | 剩余气体 | |
化学式 | 物质的量/摩 | |
分析n(CO2)=0.1xmol, n(CO)=0.1(1-x)mol(0<x<1) n(Na2O2)=3.9g/(78g/mol)=0.05mol
当CO与Na2O2恰好完全反应时,根据关系CO——Na2O2,有n(CO)=n(Na2O2)。
即:0.1(1-x)=0.05 x=0.5(临界值)
讨论:1)当0<x<![]() 时,Na2O2与CO2反应,Na2O2耗完,且CO有剩余,CO2的量不变。
时,Na2O2与CO2反应,Na2O2耗完,且CO有剩余,CO2的量不变。
CO + Na2O2=Na2CO3 过量的CO为0.1(1-x)-0.05=(0.05-0.1x)mol,
即最终剩余气体由0.1mol CO2和(0.05-0.1x)molCO组成。
(2)当x=1/2时,0.05mol 的CO恰好与0.05mol 的Na2O2完全反应,最终只有0.05mol 的CO2气体。
(3)当1/2<x<1时,CO与Na2O2反应,CO耗完,剩余Na2O2再与部分的CO2反应并生成O2。
Na2O2+CO=Na2CO3 剩余的Na2O2为0.05-0.1(1-x)=(0.1x-0.05)mol。
由方程式2Na2O2+2CO2=2Na2CO3+O2可知,(0.1x-0.05)molNa2O2与(0.1x-0.05)molCO2反应得(0.05x-0.025)molO2。
剩余的CO2为0.1x-(0.1x-0.05)=0.05mol,生成的O2为(0.05x-0.025)mol。
综上所述,所得结论如表2。
表2 反应结果
x值 | 剩余气体 | |
化学式 | 物质的量/摩 | |
0<x<1/2 | CO2 | 0.1x |
CO | 0.05-0.1x | |
x=1/2 | CO2 | 0.05 |
1/2<x<1 | CO2 | 0.05 |
CO | 0.05x-0.025 | |
变式二:Na2O2+CO2+NO型
解题精要:可发生的反应有:2Na2O2+2CO2=2Na2CO3+O2(体积减半)①;2NO+O2=2NO2 ②;由①+②可得:CO2+NO+Na2O2=NO2+Na2CO3(体积减半)③。
从以上不难看出,反应过程中存在一个临界点,即a∶b=1∶1。
讨论:
(1)当a∶b=1∶1时,反应恰好按③进行,c=![]() (a+b)
(a+b)
(2)当a∶b<1∶1时,反应按③进行后,剩余NO体积不变化,则c<![]() (a+b)
(a+b)
(3)当a∶b>1∶1时,反应按③进行,剩余CO2按①进行后,体积减少一半,则c=![]() (a+b)
(a+b)
由上分析可得结论:
(1)V(CO2) :V(NO)≧1∶1时,反应后气体的总体积为原来混合气体体积的![]()
(1)V(CO2) :V(NO)<1∶1时,反应后气体的总体积大于原来混合气体体积的![]()
例8:标况下,a LCO2气体通过足量Na2O2所得气体b LNO混合时,可得c L气体,以下表达式错误的是( )。
A.若a<b,则c>![]() (a+b) B.若a<b,则c<
(a+b) B.若a<b,则c<![]() (a+b)
(a+b)
C.若a>b,则c=![]() (a+b) D.若a=b,则c=
(a+b) D.若a=b,则c=![]() (a+b)
(a+b)
答案为B。
题型示例五:Na2O2与H2O、CO2共同反应及其变式
解题精要:(1)由它们之间的反应方程式可知:CO2、H2O(气)与过量的Na2O2反应,所得O2为同况下CO2、H2O(气)体积的一半;
(2)2CO+O2===2CO2 ①,2H2+O2===2H2O ②,2CO2+2Na2O2===2Na2CO3+O2 ③,2H2O2+2Na2O2===4NaOH+O2 ④
将①③合并得:CO+Na2O2===Na2CO3 ⑤ ,将②④合并得:H2+Na2O2===2NaOH ⑥
由⑤⑥式可以看出Na2O2固体增重的质量就是与CO2、H2O(气)相同物质的量的CO 和H2 的质量。
(3)CO2和H2O(气)同时与过氧化钠共存时,总的反应效果是:二氧化碳先与Na2O2反应,完全反应后,水再与Na2O2反应。
例9: CO 与H2 混合气体3g 和足量的氧气燃烧后,在150℃ 时将混合气体通过足量的Na2O2 后,Na2O2增重的质量为( )
A.1.5g B.3g C.6g D.无法计算
答案为B
例10:200℃时11.6g CO2和H2O的混合气体与足量的Na2O2充分反应后,固体质量增加了3.6g,则原混合气体的平均分子量为( )。
A.5.8 B.11.6 C.23.2 D.46.4
分析:设含CO2 xmol,H2O ymol。
![]()
解得:x=0.1 y=0.4 m(CO2、H2O)=![]()
n(O2)=![]() ,
,
则CO2和H2O总物质的量为氧气物质的量的2倍,
则m(CO2、H2O)=![]()
答案为C。
例11:1mol 二氧化碳和1mol 水蒸气的混合气体通过1.5mol 过氧化钠(100℃以上),充分反应后,①有哪些物质生成,它们的物质的量分别为多少?②过氧化钠增重多少克?
分析:因为气体的物质的量大于过氧化钠的物质的量,且相差0.5mol,而0.5mol<1mol,所以过量的是水蒸气且物质的量为0.5mol,产物为 Na2CO3、NaOH 、 O2 。反应始态和终态的变化如下:
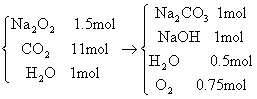
且过氧化钠增加的质量等于进入容器的气体的质量与从容器中出去的气体的质量之差,即Δm=44 g +18 g -9 g -24 g == 29 g。
例12:在100℃时,3.88 g 气体A与足量的Na2O2反应,可放出氧气,且固体的质量增加了2.28 g,由此可知,A组成为( )
A只有水蒸气 B 只有二氧化碳 C 水蒸气和二氧化碳 D 无法确定
答案选C
变式一:Na2O2+CO+H2型
解题精要:![]() ①,
①,![]() ②,
②,
①+②得总反应式:
![]()
所以反应②的增重实际上是H2O中H的质量,而水中H的质量即为反应①中H2的质量。
同理,![]() 。
。
例13:将2.1g 由CO和H2组成的混合气体(平均式量为7.2),在足量的氧气中充分燃烧后,通入足量的Na2O2固体中,固体的质量增重( )G。
A.2.1 B.3.6 C.4.2 D.7.2
答案选A
变式二:Na2O2+NaHCO3型
解题精要:NaHCO3受热先分解产生CO2和H2O(气),且二氧化碳先与Na2O2反应,完全反应后,水再与Na2O2反应。
例14:取6.60g NaHCO3和Na2O2固体混合物,在密闭容器中加热到250℃,经充分反应后排出气体,冷却后称得固体质量为5.30g。计算原混合物中Na2O2的质量分数。
分析:因二者总质量是一定值n(NaHCO3)/n(Na2O2)越大,则反应前后的质量差越大。
此题可能发生的反应为:
2NaHCO3=Na2CO3+CO2+H2O ①
2Na2O2+2CO2=2Na2CO3+O2 ②
2Na2O2+2H2O=4NaOH+O2 ③
若只发生反应①②,可得方程4NaHCO3+2Na2O2=4Na2CO3+2H2O+O2↑ ④,
若①②③同时发生,可得方程式:2NaHCO3+2Na2O2=2Na2CO3+NaOH+O2↑ ⑤,
由④⑤两方程可知在反应过程中存在两个临界点,即: n(NaHCO3)/n(Na2O2)=1n(NaHCO3)/n(Na2O2)=2
假设二者按第二个临界点恰好完全反应,且反应后质量减少X。

492/6.6g=68/x x=0.91<(6.6-5.3) g
所以NaHCO3过量,5.3g 固体全部为NA2CO3。设NaHCO3的物质的量为xmol,Na2O2的物质的量为y mol,由Na+守恒和质量守恒列等式得:
84x+78y=6.6 | x=0.06 |
| y=0.02 |
Na2O2%=((0.02×78)/6.6)×100%=23.6%
即原混合物中Na2O2的质量分数为23.6%。
例15:将NaHCO3 和Na2O2的固体混合物置于密闭容器中加热到250℃使其充分反应(保持250℃)。若反应物碳酸氢钠和过氧化钠的物质的量为未知,充分反应后测得残余固体有两种物质组成,一种为a mol,另一种为b mol,且a > b,则原固体碳酸氢钠的的物质的量为( ),过氧化钠的物质的量为( );密闭容器内气态生成物为( ),其物质的量为( )。
答案为:碳酸氢钠,a mol,过氧化钠,![]() mol,氧气,
mol,氧气,![]() mol。
mol。
变式三:Na2O2+O2+CH4或CxHy型
解题精要:抓住反应过程中氧气的总消耗量和总生成量来进行解题。
例16:将含有氧气和甲烷的混合气体通入装有过量的过氧化钠的密闭容器中,以电火花点燃,充分反应后,在温度为150℃时,压强为0帕。则甲烷和氧气的体积比为多少?
分析:设甲烷和氧气的体积分别为x L和y L,则甲烷完全燃烧要消耗2x L的氧气;而在于x L甲烷完全燃烧产生x LCO2和2x LH2O(气),这些CO2和H2O(气)与过氧化钠反应,产生1.5x L氧气。由于反应后,压强为0帕,说明没有气体剩余,说明消耗的氧气等于原加入的氧气和反应过程产生的氧气之和。即:2x=1.5x+y,0.5x=y,x:y=1:2。
例17:已知甲烷与氧气的混合气体,在有足量过氧化钠存在的密闭容器中点燃充分反应,总的化学方程式为:
2CH4+O2+6Na2O2=2Na2CO3+8NaOH
(1)假设原混合气体中CH4、O2的物质的量分别为x mol、y mol,反应后气体的物质的量为n mol,试确定x与y在不同比值条件下的n(值)。将结果填入表3。
表3 x∶y与n的关系
x∶y |
n |
(2)某烃( CxHy)与O2的混合气体在上述条件下反应。若该烃与O2的物质的量之比分别为3∶3和2∶4时,充分反应后剩余气体的物质的量相同。计算推断该烃可能的分子式。
分析:(1)x∶y=2∶1时,恰好完全反应,n=0。
(2)x∶y>2∶1时,甲烷过量,n=x-2y。
(3)x∶y<2∶1时,氧气过量,n=(y-x)/2。
(3)由反应物的物质的量之比为3∶3和2∶4,知充分反应后剩余气体的物质的量相同,可知混合物中某烃和氧按上述条件反应的物质的量之比为2∶3。
CxHy+0.5x O2+0.5(2x+y ) Na2O2→x Na2CO3+y NaOH
1∶x/2=2∶3 x=3
故该烃的分子式可能为:C3H4,C3H6,C3H8。
例17:石油及其分馏产物在供氧不足时燃烧,常常产生CO,这也是常见的大气污染物之一。将某气态烃在5倍体积的纯氧中燃烧,产物通过足量Na2O2并在电火花连续作用下充分反应,生成的气体体积缩小到燃烧后产物体积的3/8(气体体积都在100℃以上,1.01×105Pa时测定)
(1)试写出通式为CHy的某烃在供氧不足时燃烧的化学方程式(CO2的系数设定为m)。 。
(2)当m=2时,求该烃的分子式。 。
(3)若1摩某气态烃在供氧不足时燃烧,产物在足量Na2O2和电火花连续作用下产生3摩氧气,且固体Na2O2增重范围为90g≤ΔW≤118g,求烃可能的分子式和燃烧产物CO与CO2的物质的量之比,将结果填入下表
烃的分子式 | n(CO)/n(CO2) |
答案为:(1)CxHy +(x/2+y/4+m/2)O2—→mCO2 + y/2H2O + (x - m)CO
(2)C4H8
(3)
烃的分子式 | n(CO)/n(CO2) |
C3H8 C4H6 | 1/2 1/3 |
变式四:Na2O2+O2+混合气体型
解题精要:混合气体可以是多样的:可以为烃、烃的衍生物,也可以是H2 、CO等的一种或多种成分与O2混合,只要气体仅含C、H、O三种元素,我们就可以将其假想为某烃CxHyOz
根据方程式![]()
衍生物耗氧![]()
其燃烧产物可生成氧![]()
二者相等可解得x:z=1:1
从中我们可以得出如下结论:
结论一:混合气体中无论含氢量多少,只要总的碳原子和氧原子的物质的量之比存在C:O=1:1,其通入足量的Na2O2 密闭体系中反应完全后则无气体剩余。
例18:将H2 、C2H5OH、O2 混合蒸气通入Na2O2 密闭容器中,用电火花引燃,反应完全后,体系内的压强为零帕斯卡,则气体的混合比可能为
A、3:4:2 B、3:1:2 C、7:2:1 D、9:3:4
答案为A、C
例19:某有机物与氧气以2:3混合,通入足量Na2O2 密闭体系,引燃后充分反应无气体剩余,则该烃可能为
A、乙醚 B、甲醛 C、甲醇 D、乙酸乙酯
答案为A
结论二.m克烃的衍生物(或从组成上可看成为烃的衍生物的混合气体),若有通式CxH yOx ,则其完全燃烧的产物通入足量的过氧化钠,过氧化钠增重m克。
例19:41.6g 甲醇完全燃烧产物通入足量的Na2O2 固体,过氧化钠增重多少克?
答案:因为甲醇的化学式为CH3OH, C:O=1:1,所以增重41.6g
例20:32g CH3COOH和CH3OH混合气体完全燃烧产物通入足量的Na2O2 固体,过氧化钠增重32g,则二者的物质的量之比( )
A、一定是2:1
B、一定是2:1 或3:2
C、一定是3:2
D、任意比
答案为D。
题型示例六:有关Na2O2的探究性实验题
一、探究Na2O2的含量
例21:怎样测定Na2O、Na2O2混合物中Na2O2的含量,简述实验方案。
答案:1.方法一称取a g混合物置于烧瓶中,由分液漏斗向烧瓶中逐滴加水,待不再产生气体时,调整量筒高度使其中液面与广口瓶中液面相平,读出水的体积VmL(即产生的O2体积),测出此时的温度、压强,计算出气体摩尔体积为VmL·mol-1。根据O2物质的量计算出Na2O2的质量。
方法二 在一个质量Mg的烧杯中称取a g混合物,向其中加入b mL 水(足量),充分反应后称量,直到两次称量结果相差不超过0.1g(托盘天平),得烧杯及溶液质量共c g。根据产生的O2的质量(m+a+b—c)计算出Na2O2的量。
方法三 称取a g混合物,加水溶解后配成500 mL 溶液,取25 mL 溶液,滴加酚酞作指示剂,用b mol·L-1盐酸滴定,至终点时,用去盐酸cmL。根据混合物质量和溶于水产生的NaOH总物质的量(2×10-2bc mol)计算出Na2O2的质量。
方法四 称取a g混合物置于一质量为m g的玻璃管中,从另一端向玻璃管中通CO2,直至过量(即两次称量相差不超过0.1g),称得玻璃管及固体共b g。根据反应前后固体的质量计算出Na2O2的质量。
方法五 称取 a g混合物,加足量稀盐酸后,将溶液转移到质量为m g的干燥蒸发皿中,蒸发溶剂后,称得蒸发皿和NaCl晶体共b g。根据NaCl的质量(b g—m g)和混合物的质量计算出Na2O2的量。
方法六 称取Ag混合物置于一质量为m g的玻璃管中,通入纯的氧气并加热,充分反应后,再缓缓通入O2,冷却后称量,重复通O2 、加热、冷却、称量,到两次称量相差不超过0.1g ,称得玻璃管及固体质量共为 b g。根据消耗 O2的质量(b g—a g)先算出Na2O的质量,再计算出 Na2O2的质量。
二、探究反应原理
例22:某研究性学习小组,在做Na2O2与水反应实验时,发现Na2O2与水反应后的溶液中滴加酚酞试液溶液呈现红色,但红色很快褪色,甲、乙、丙三同学对此现象分别做了如下推测:
甲:因为反应后试管很热,所以可能是溶液温度较高使红色褪去。
乙:因为所加水的量较少,红色褪去可能是生成的NaOH溶液浓度较大的影响。
丙:Na2O2具有强氧化性,生成物中O2、H2O2(可能产物)等也具有强氧化性,可是氧化漂白了红色物质。
(1)验证甲同学的推测是否正确的方法是________,验证乙同学的推测是否正确的方法是____________,
当出现__________现象时,即说明丙同学的推测正确。
(2)有同学提出用定量的方法探究丙同学方案中是否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积,与理论值比较,即可得出结论。
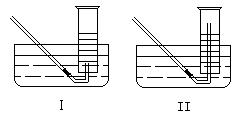
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用右图装置中的_______,理由是______________。
②若在标准状况下测量气体的体积,应选用量筒的大小规格为____(选填“100mL”、“200mL”、“500mL”或“100mL”)。
答案:(1)冷却后加酚酞试液或冷却后看溶液是否变红
加水稀释后看溶液是否变红(或加较多的水反应后滴加酚酞试液看是否变红)
冷却后及加水稀释后均不变红
(2)①Ⅱ 防止气体冷却时发生倒吸现象 ②500mL
三、探究反应的条件
23:为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”.课题研究小组的同学们设计了如图7-5的实验装置,分别进行甲、乙两次实验:
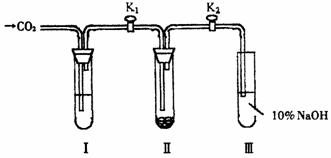
图7-5
实验甲:干燥的二氧化碳和过氧化钠的反应
在干燥的试管Ⅱ中装入Na2O2,在通入CO2之前,关闭K1和K2.在试管Ⅰ内装入试剂x后,打开K1和K2,通入CO2,几分钟后,将带火星的木条插入试管Ⅲ的液面上,观察到木条不复燃,且Ⅱ中的淡黄色没有变化.
实验乙:潮湿的二氧化碳和过氧化钠的反应
在试管Ⅰ内装入试剂Y,其他操作同实验甲,观察到木条复燃,且Ⅱ中的淡黄色变为白色.
试回答下列问题:
(1)在装入Na2O2后,通入CO2前,关闭K1和K2的目的是________.
(2)在实验甲中,试剂x是________,其作用是_______.
在实验乙中,试剂y是________.
(3)根据上述两个实验现象,得到的结论是__________.
(4)试管Ⅲ中的NaOH溶液的作用是________.
(5)为了确保实验现象的准确性,制备CO2所用的反应物最好选用________(填编号,多选扣分)
A.大理石 B.小苏打 C.烧碱 D.盐酸 E.稀硫酸 F.稀硝酸
(6)CO2和Na2O2的反应机理可用示踪原子分析加以证明,请完成下列反应:
Na2O2+C18O2+H2O→
答案:(1)防止CO2受潮.
(2)x是浓硫酸,其作用是除去CO2中的水. y是CO2的饱和溶液(或水)
(3)二氧化碳只有在水存在时才能和过氧化钠反应.
(4)除去混在氧气中的过量二氧化碳.
(5)B、E
(6)2Na2O2+C18O2+2H218O→2Na2C18O3+O2↑+2H2O
四、探究反应的产物
例24:有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
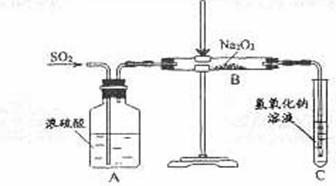
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成Na2SO3和O2,该反应的化学方程式是:
。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。
为检验是否有Na2SO4生成,他们设计了如下方案:

上述方案是否合理? ,请简要说明两点理由:
① ,② 。
答案:(1)2Na2O2+2SO2=2Na2SO3+O2
(2)取白色固体,加稀硫酸,产生能使晶红溶液褪色的气体。
(3)不合理 稀硝酸能将亚硫酸钡氧化为硫酸钡
如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根
某同学进行如下实验:在试管中加入少许淡黄色Na2O2 粉末,加入适量水直至气体不再放出,将所得溶液均分2等份,在其中一支试管中加入酚酞溶液呈显红色,0.5min内红色褪去;在另一支试管中加少许MnO2 ,可见有气体放出,该气体可使带火星的木条重新燃烧,待气体全部褪去后,滴入酚酞试液呈现红色,而且持久不会褪色。
例25:(1).Na2O2跟水反应所得溶液使酚酞变红原因是Na2O2 跟水反应生成 NaOH使酚酞变红。0.5min内试液红色褪去的原因是另一生成物H2O2 具有氧化性使红色褪去。表示Na2O2 是水反应方程式,
应写成2Na2O2+2H2O===4NaOH+O2↑ Na2O2+2H2O===2NaOH+H2O2
(2)在Na2O2 跟水反应所得溶液中加入少许MnO2 后,发生反应的化学方程式是
![]() MnO2的作用是催化剂。
MnO2的作用是催化剂。
6.“二氧化碳是否在有水存在时才能与过氧化钠反应”这个问题在实验室里可通过以下实验加以证明:
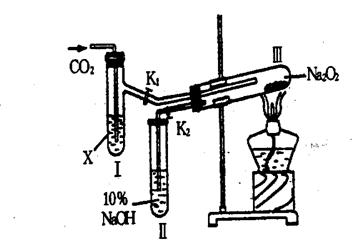
(1)按图装置,在干燥的试管3中装入Na2O2后,在通入CO2 之前,应事先用弹簧夹(K1,K2)夹持好,目的
(2)试管1内的试剂x应该是 时,打开弹簧夹K1,K2,加热试管3约5min 后,将带火星的木条插入管2的液面上,可观察到带火星的木条不能燃烧,且3内淡黄色粉末没有发生变化,则所得的化学结论是
(3)试管1内试剂为CO2 和饱和水溶液时,其他操作同(2),通过 的现象证明Na2O2 与潮湿的CO2 能反应且放出 O2 。
答案:(1)防止空气中的CO2和H2O进入干燥的试管3
(2)浓H2SO4;干燥的CO2不能与Na2O2反应
(3)淡黄色固体逐渐变成白色固体
题型示例七:信息题
例26:事实上许多氧化物在一定条件下能与Na2O2反应,且反应极有规律,
如Na2O2+SO2=Na2SO4 Na2O2+2SO3=2Na2SO4+O2。据此,你认为下列方程式正确的是( )。
A.2Na2O2+2Mn2O7=4NaMnO4+O2
B.Na2O2+2NO2=2Na2NO3+O2
C.2Na2O2+2N2O3=4Na2NO2+O2
D.2Na2O2+2N2O5=2Na2NO3+O2
分析:由题给信息可知:Na2O2与低价态氧化物反应生成最高价态含氧酸盐,与最高价态氧化物反应生成最高价态的含氧酸盐和氧气。所以答案为A、D。

- 全部评论(0)
