关于镁铝原电池问题的讨论
时间:2017-04-18 19:03 来源: 作者:傅芳 点击:次 所属专题: 镁铝原电池
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
以镁、铝为电极,以稀NaOH溶液为电解质溶液构成的原电池中,谁是负极?《化学教育》中的“谈谈化学实验设计的创意”(2003年第11期第46页)《中学化学》中的“有关原电池的电极反应式的书写”(2002年第12期第13页)“谈电极反应式书写技能的培养”(2003年第3期第44页)等文章都认为铝是负极。这一结论已得到大部分中学教师的认可,笔者对这一问题专门做了多次实验并查阅许多相关书籍,觉得很有必要对这一观点进行讨论,以飨读者。
1 实验操作
如图1所示,剪约
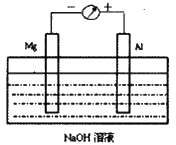
图1
2 实验现象
开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小直至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。
3 实验解释
镁、铝在1mol/L的NaOH溶液中,电极电势为:
H2AlO3-+H2O+3e-=Al+4OH- φθ=-2.35V
Mg(OH)2+2e-=Mg+2OH- φθ=-2.69V
故镁为负极,铝为正极,电子从镁条流向铝片,电表指针向右偏移。电极反应为:
负极:Mg-2e-+2OH-=Mg(OH)2
正极:2H++2e-=H2↑
由于在镁条表面不断生成的Mg(OH)2并没有形成沉淀,而是紧密覆盖于镁条的表面形成膜层,使镁条表面很快发生了钝化。用电流计检测证明镁条表面的膜层具有电子导电性(电子导体),虽然电极反应仍可进行,但依靠Mg2+从镁条表面转移到溶液的溶解过程却受到了抑制,使镁极电势正移,最终出现镁极电势高于铝极电势的结果:铝极转变为负极,表面钝化的镁条为正极,电子从铝片流向镁条,电表指针向左偏移。电极反应为:
负极:Al-3e-+4OH-=AlO-2+2H2O
正极:O2+4e-+2H2O=4OH-(主要);2H++2e-=H2↑(极少)
这就是说,由于在NaOH溶液中镁条发生了钝化,不仅改变了原电池的正负极,而且正极反应也由析氢变为主要吸氧。铝片表面仍有许多气泡的原因可能是铝片不纯导致铝片在NaOH溶液中形成了许多微小原电池。
综上所述,将镁、铝放入NaOH溶液中构成原电池时,开始镁为负极,铝为正极,发生析氢腐蚀;片刻后,Al为负极,表面钝化的镁条为正极,发生吸氧腐蚀。
参考文献
[1] 北京师范大学等三校无机化学教研室.无机化学(上册).第4版,北京:高等教育出版社,2002:425
[2] 李荻.电化学原理.北京:北京航空航天大学出版社,2002:406-418

- 全部评论(0)
