化学反应规律中的特殊性
时间:2022-08-11 16:31 来源: 作者:耿艳 点击:次 所属专题: 化学反应规律 一般与特殊
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
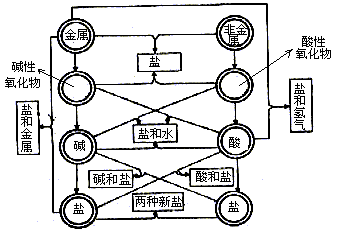
在初中化学课本中列出了各类型物质间的相互反应关系图(如下图)。但随着高中阶段氧化还原反应概念的加深和一些新物质的性质的学习,这些反应规律中多了一些特殊性。
1. 金属单质
一般金属活动性顺序表中位于H之前的金属才能与酸反应且放出H2,但金属与强氧化性酸(如浓H2SO4、浓HNO3、稀HNO3)反应均不产生H2。
(2)金属与盐溶液一般发生置换反应,但Cu与FeCl3溶液反应:
![]() (非置换反应)。
(非置换反应)。
(3)金属单质一般不与碱溶液反应,但Al能与强碱溶液反应:
![]()
2. 非金属单质
(1)非金属单质与碱溶液一般发生歧化反应(如![]()
![]()
![]() ),但Si与碱溶液反应为:
),但Si与碱溶液反应为:
![]()
(2)非金属单质一般不与酸反应,但C、S、P等能与强氧化性酸反应。如:
![]() 。
。
II、氧化物参与反应:
(1)酸性氧化物一般不与酸反应,但强还原性的SO2能与HNO3、HClO等反应。
(2)酸性氧化物CO2和SO2与碱或盐溶液反应,若氧化物不足量,则生成其正盐;若氧化物过量,则生成其酸式盐。但CO2与苯酚钠溶液反应,不管CO2是否过量均只能生成NaHCO3。
(3)金属氧化物一般不能与碱反应,但Al2O3能与碱反应生成盐(![]() )和水。
)和水。
III、酸、碱参与的反应:
(1)一般是强酸制弱酸,但弱酸有时也能制强酸,如:
![]() (Cl2将H2SO3氧化)。
(Cl2将H2SO3氧化)。
(2)酸与酸之间一般不能发生反应,但氢硫酸能与浓H2SO4、HNO3、H2SO3等能发生氧化还原反应。
(3)酸与碱一般只发生中和反应,但Fe(OH)3与HI、Fe(OH)2与HNO3除发生中和反应外,同时发生氧化还原反应:
![]() 。
。
(4)酸与盐一般发生复分解反应生成新盐和新酸,但H2S与FeCl3溶液、HCl与Fe(NO3)2溶液发生的是氧化还原反应:
![]() 。
。
(5)碱与碱一般不发生反应,但AgOH可以与氨水反应(银氨溶液的配制)。
IV、盐参与的反应:
盐与盐反应一般生成两种新盐,但NaHSO4与Na2CO3溶液反应产生CO2气体;FeCl3与Na2CO3溶液发生双水解反应:
![]() 。
。

- 全部评论(0)
