原电池图形题考点精评
时间:2022-05-09 08:20 来源: 作者:李萱 点击:次 所属专题: 原电池工作原理
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
原电池图形题是考察学生基本知识、实验的观察及分析能力、实际生活知识三者结合在一起的综合能力题。最初学生掌握起来难度较大。下面以8个考点为主线进行分析。
一、判断是否形成原电池
牢记形成原电池的三个条件:①两个活动性不同的金属或金属和非金属(如石墨)做电极。②电解质溶液。③形成闭合回路
考点一:原电池的电极(石墨电极和Pt电极是良好的惰性电极)
例:下图装置中能够组成原电池的是___________。
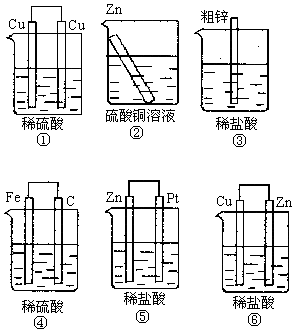
答案:③④⑤⑥
提示:③的粗锌与酸接触与生铁的钢铁腐蚀相似。
考点二:原电池的电解质溶液(至少能与其中一种电极反应的)
例:下图装置中不能组成原电池的是______。
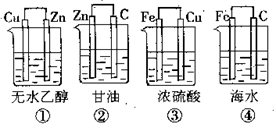
答案:①②
考点三:原电池的闭合回路(可串联电流表![]() 或安培表
或安培表![]() )
)
例:下图装置中不能组成原电池的是_______。
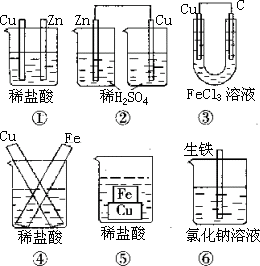
答案:①②
提示:④、⑤、⑥两个电极直接相连,不形成外电路,但构成闭合回路,形成原电池。
二、电极的判断
电极特征:
正极:较不活泼金属或非金属作正极;发生还原反应(电极材料不反应)。
负极:较活泼金属作负极;发生氧化反应(电极材料反应)。
考点四:比较两种金属的金属性强弱
例:有A、B、C三种金属,两两分别接触并同处于稀H2SO4中,反应结果如图,三种金属活动性由大到小的顺序是_______。

答案:C>B>A。
考点五:金属腐蚀加快或减慢的判断。
例:分别放置在如图所示装置(都盛有0.1mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最快的是( )
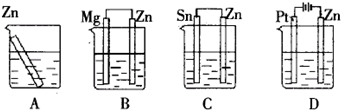
答案:C
考点六:原电池的电极质量变化。
例:如下图所示的装置,在盛有水的烧杯中,铁圈和银圈的相接处吊着一根绝缘的细丝,使之平衡。小心地从烧杯中央滴入CuSO4溶液。
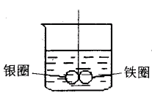
(1)片刻后可观察到的现象是(指悬吊的金属圈)_______。
A.铁圈和银圈左右摇摆不定
B.保持平衡状态不变
C.铁圈向下倾斜
D.银圈向下倾斜
(2)产生上述现象的原因是____________________________。
答案:(1)D(2)加入CuSO4溶液后,形成Fe-Ag原电池;Fe溶解,铁圈减轻,Cu2+在Ag圈上得电子析出,银圈增重
三、原电池的电极反应
原电池电极反应特征:①负极反应一般比较简单,金属原子失电子;②正极反应=氧化还原总反应-负极反应;③正、负极的电极反应的电子数必须相等。
考点七:电极反应方程式的书写。
例:如下图由浓H2SO4、Cu、Al组成一个原电池,已知Cu、Al过量。试写出可能的电极反应式,并指出正、负极及电极反应类型。
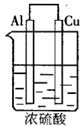
(1)Al片:___________、___________。(可不填满,也可补充,下同);
(2)Cu片:___________、___________。
答案:(1)开始Al片为正极:2H2SO4+2e-=SO2↑+2H2O+(或4H++ +2e-=SO2↑+2H2O)(还原反应)、后来为负极:2Al-6e-=2Al3+(氧化反应)
(2)开始Cu片为负极:Cu-2e-=Cu2+(氧化反应)、后来为正极:6H++6e-=3H2↑(还原反应)
思考:如果将浓H2SO4改为浓HNO3则情况相同。
考点八:实验设计能力
例:请利用氧化还原反应:Cu+2FeCl3=2FeCl2+CuCl2设计一个原电池。
解析:化学反应符合设计要求,该氧化还原反应可拆分为如下两个半反应:
氧化半反应(负极反应)
Cu-2e-=Cu2+
还原半反应(正极反应):
2Fe3++2e-=2Fe2+
结合原电池构成的条件而定,负极材料为铜,正极材料可用石墨,电解质溶液为FeCl3溶液。
答案:该原电池的设计图为: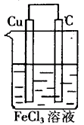

- 全部评论(0)
