燃料电池电极反应式书写的规律
时间:2017-04-25 20:00 来源: 作者:何清松 点击:次 所属专题: 燃料电池 电极反应式
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
原电池知识是中学化学中的重要基本概念,也是近年来高考的热点,在学习原电池时,学生最感到困难的是电极反应式的书写,特别燃料电池的电极反应式的书写,为了帮助同学们准确把握这类电池的电极反应式的写法,我结合自己的教学体会谈谈这方面的问题,供大家参考。
燃料电池是一种不经燃烧,将燃料的化学能经过电化学反应直接转变为电能的装置,它和其它电池中的氧化还原反应一样,都是自发的化学反应,不会发出火焰,其化学能可以直接转化为电能的一种电池。燃料即化石燃料以及由此得到的衍生物,如氢、肼、烃、煤气等液体和气体燃料;氧化剂仅限于氧和空气。燃料电池基本结构与一般化学电源相同,由正极(氧化剂电极)、负极(燃料电极)和电解质构成,但其电极本身仅起催化和集流作用。燃料电池工作时,活性物质由外部供给,因此,原则上说,只要燃料和氧化剂不断地输入,反应产物不断地排出,燃料电池就可以连续放电,供应电能。
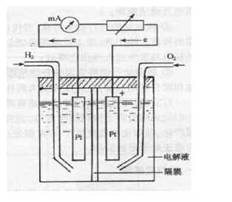
氢氧燃料电池基本结构
所有的燃料电池的工作原理都是一样的,其电极反应的书写同样是有规律可循的。书写燃料电池电极反应式的步骤类似于普通原电池,在书写时应注意以下几点:
1.电池的负极一定是可燃性气体,失电子,元素化合价升高,发生氧化还原反应;电池的正极一定是助燃性气体,得电子,化合价降低,发生还原反应。
2.燃料电池两电极材料一般都不参加反应,反应的是通到电极上的燃料和氧气,两电极只是传导电子的作用。
3.电极反应式作为一种特殊的离子反应方程式,也必需遵循原子守恒,得失电子守恒,电荷守恒。
4.写电极反应时,一定要注意电解质是什么,其中的离子要和电极反应中出现的离子相对应,在碱性电解质中,电极反应式不能出现氢离子,在酸性电解质溶液中,电极反应式不能出现氢氧根离子。
5.正负两极的电极反应式在得失电子守恒的条件下,相叠加后的电池反应必须是燃料燃烧反应和燃料产物于电解质溶液反应的叠加反应式。
例1:氢氧燃料电池一般是以惰性金属铂(Pt)或石墨做电极材料,负极通入H2,正极通入 O2,电解质溶液通常选用KOH。在负极上氢气失去电子变成 H+进入溶液,H+又与溶液中的OH-继续反应生成H2O,因此在负极发生的反应为H2+2e- = 2H+ ,2H+ + 2OH- = 2H2O,所以: 负极的电极反应式为:H2 - 2e- + 2OH- = 2H2O; 正极是O2得到电子,即:O2 + 4e- = O2- ,O2-在碱性条件下不能单独存在,只能结合H2O生成OH-即:O2- + 2H2O = 4OH- ,因此,正极反应式为:O2 + H2O + 4e- = 4OH- 。 总反应为:2H2 + O2 = 2H2O ;若在酸性条件下, 负极反应式为:H2 +2e- = 2H+ ,正极反应式为:O2 + 4H+ + 4e- = 2H2O(O2 + 4e- = O2- ,O2- + 4H+ = 2H2O) 总反应为:2H2 + O2 = 2H2O。
例2:甲烷燃料电池(电解质溶液为KOH溶液), 甲烷燃料电池的电解质溶液为KOH,生成的CO2还要与KOH反应生成K2CO3,所以总反应为:CH4 + 2KOH+ 2O2 = K2CO3 + 3H2O。
负极反应有:CH4 - 8e- + 8OH- = CO2 + 6H2O CO2 + 2OH- = CO32- + H2O, 负极反应式为:CH4 + 10OH- + 8e- = CO32- + 7H2O
正极发生的反应有:O2 + 4e- = O2- 和O2- + H2O = 2OH-
所以正极反应式为:O2 + 2H2O + 4e- = 4OH-
[技巧1]燃料电池的负极反应,一般较难写出,而正极反应和电池总反应却较易写出。用电池总反应减去正极反应可得负极反应,这是写负极反应式的一种巧妙方法。
甲烷燃料电池总离子反应式为:CH4 + 2OH-+ 2O2 = CO32- + 3H2O ①
正极反应式为:O2 + 2H2O + 4e- = 4OH- ②
故负极反应式应为:①-②*2 即得CH4 + 10OH- - 8e- = CO32- + 7H2O
[技巧2]根据得失电子守恒,原子守恒,电荷守恒直接书写较复杂的负极电极反应式。
负极中,甲烷被氧化为二氧化碳,二氧化碳在碱性条件不能存在,结合氢氧根生成碳酸根。甲烷中碳元素化合价由-4价升高到碳酸根中的+4价,故1 mol 甲烷失去8 mol 电子,结合OH-生成1 mol CO32-,再根据电荷守恒,电极反应式右侧CO32-带两个单位负电荷,故左侧应该有10 mol OH-,再根据原子守恒,电极反应式右侧加上7 mol H2O。即得CH4 + 10OH- - 8e- = CO32- + 7H2O
例3:熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650 ℃下工作的燃料电池,完成有关的电池反应式:
负极反应式:2CO+2CO32-![]() 4CO2+4e-
4CO2+4e-
正极反应式: 。
总电池反应式: 。
解析:根据题意可以判断CO做为反应的还原剂,即在反应中失去电子,做原电池的负极;空气与CO2做正极,所以在正极上是O2得到电子:O2+2H2O+4e-=4OH-,这是在不考虑二氧化碳的情况下写的正极反应,所以当我们考虑到正极上的物质时,正极反应就变成了O2+4e-+2CO2=2 CO32-,总反应在正负极的是电子数目相等情况下把两个电极反应相加即可:O2+2CO=2CO2。
习题专练:
某原电池中盛有KOH浓溶液,若分别向________(填“正”或“负”,下同)极通入可燃性气体,向________极通入O2,则电路中就有电流通过,试完成下列问题:
可燃性气体 | 正极反应 | 负极反应 | 电池总反应 | |
(1) | H2S | |||
(2) | CO | |||
(3) | C2H4 | |||
(4) | C3H8 | |||
(5) | CH3OH | |||
(6) | C2H5OH |
答案:负 正
正极反应 | 负极反应 | 电池总反应 |
O2+4e-+2H2O==4OH- | H2S-6e-+8OH- ====SO32-+5H2O | 2H2S+3O2+4OH-====2SO32-+4H2O |
CO-2e-+4OH- =CO32-+2H2O | 2CO+O2+4OH-====2CO32-+2H2O | |
C2H4-12e-+16OH-====2CO32-+10H2O | C2H4+3O2+4OH-=====2CO32-+4H2O | |
C3H8-20 e-+26OH- === 3CO32-+ 17H2O | C3H8+5O2+6OH-=====3CO32-+7H2O | |
CH3OH-6 e-+8OH- === CO32-+6H2O | 2CH3OH+3O2+4OH-====2CO32-+6H2O | |
C2H5OH-12e-+16OH- ===2 CO32-+11H2O | C2H5OH+3O2+4OH-====2CO32-+5H2O |
总之,对于原电池的电极反应式的书写来说,最重要的是明白原电池的工作原理,这一点对学生来说不难理解,但是对于有电解质溶液参与的电极反应来说就不知如何是好,正负极也能找到,就是写不出电极反应式,负极失电子正极得电子都知道,却忽略了得失电子变成离子后要进入溶液中,如果溶液中存在的离子与在正极负极得失电子变成的离子不能共存,则要继续反应,反之,不反应共存于溶液中。如果能分析清楚这些,那么难题也就迎刃而解了。

- 全部评论(0)