晶体结构与性质考点
时间:2016-01-30 15:36 来源:未知 作者:陈恒 点击: 次 所属专题: 晶体结构与性质
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
晶体结构与性质是高考命题的热点内容,它不仅是由于增添了晶胞知识点而备受关注,而是由于涉及元素组成、微粒间作用力及性质比较等内容,所以在注重综合能力考查的命题方向上,晶体无疑成为命题的重点。
一、考查晶体类型的判断及性质比较
晶体类型判断与性质比较是命题的常考点。判断晶体类型的常用方法有:①根据构成晶体的晶格质点及质点间的作用判断;②根据导电性判断:离子晶体熔化及水溶液能导电;原子晶体一般不导电;分子晶体固态、熔化状态不导电;金属晶体是良导体。③根据晶体的熔点判断:离子晶体熔点较高,原子晶体熔点高,分子晶体熔点低。④根据物质的分类判断:金属氧化物、强碱和绝大多数盐类是离子晶体;大多数非金属单质(除石墨、金刚石、晶体硅等外)、气态氢化物、非金属氧化物(除二氧化硅外) 、酸、绝大多数有机化合物(除有机盐外)是分子晶体;常见的原子晶体单质有金刚石、晶体硅;常见的原子晶体化合物有碳化硅、二氧化硅等;金属单质(除汞外)与合金是金属晶体。
例1.(09山东)![]() C和Si元素在化学中占有极其重要的地位。
C和Si元素在化学中占有极其重要的地位。
![]() (1)写出Si的基态原子核外电子排布式 。
(1)写出Si的基态原子核外电子排布式 。![]() 从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
![]() (2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
![]() (3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。
(3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。
![]() (4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成![]() 键和
键和![]() 键,SiO2中Si与O原子间不形成上述
键,SiO2中Si与O原子间不形成上述![]() 健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述
健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述![]() 键 。
键 。
![]() 解析:(1)C、Si和O的电负性大小顺序为:O>C>Si。(2)晶体硅中一个硅原子周围与4个硅原子相连,呈正四面体结构,所以杂化方式是sp3 。(3)SiC电子总数是20个,则氧化物为MgO;晶格能与所组成离子所带电荷成正比,与离子半径成反比,MgO与CaO的离子电荷数相同,Mg2+半径比Ca2+小,MgO晶格能大,熔点高。(4) Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
解析:(1)C、Si和O的电负性大小顺序为:O>C>Si。(2)晶体硅中一个硅原子周围与4个硅原子相连,呈正四面体结构,所以杂化方式是sp3 。(3)SiC电子总数是20个,则氧化物为MgO;晶格能与所组成离子所带电荷成正比,与离子半径成反比,MgO与CaO的离子电荷数相同,Mg2+半径比Ca2+小,MgO晶格能大,熔点高。(4) Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
![]() 答案:(1)1s22s22p63s23p2 ;O>C>Si ;(2) sp3 ; 共价键 ;(3)Mg;Mg2+半径比Ca2+小,MgO晶格能大 (4)Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
答案:(1)1s22s22p63s23p2 ;O>C>Si ;(2) sp3 ; 共价键 ;(3)Mg;Mg2+半径比Ca2+小,MgO晶格能大 (4)Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
点评:本题的(2)问是考查晶体硅的结构问题,从而利用迁移思路解答解答。问题(3)则主要考查晶体的熔沸点高低问题,其实质还涉及晶体类型判断及影响粒子间作用力大小的因素等问题。
二、考查晶胞问题
晶胞是晶体的最小重复结构单元,是新课标的新增内容,近来比较受关注。常见的晶胞是六面体型,考查的问题主要集中在化学式、配位数、晶体密度或晶胞边长等内容。对于晶胞问题,首先是根据题意判断提供的图示是分子结构还是晶胞结构,若是晶胞结构时则常利用“均摊法”解答粒子个数与个数比以及配位数问题。均摊法的主要内容为①处于顶点上的粒子:同时为8个晶胞共有,每个粒子有1/8属于晶胞; ②处于棱上的粒子:同时为4个晶胞共有,每个粒子有1/4属于晶胞; ③处于面上的粒子;同时为2个晶胞共有,每个粒子有1/2属于晶胞; ④处于体心的粒子:则完全属于该晶胞。
例2、(09海南)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,
又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图:
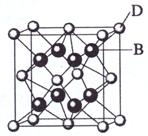
请回答:
(1)A元素的名称是 ;
(2)B的元素符号是 ,C的元素符号是 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
![]() (3)E属元素周期表中第 周期、第 族的元素,其元素名称是 ,它的+2价离子的电子排布式为
(3)E属元素周期表中第 周期、第 族的元素,其元素名称是 ,它的+2价离子的电子排布式为
(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是 (只要求列出算式)。
解析:从D、E是周期表中1—18列中E排第7列可判断E是第4周期VIIB族,所以D也在第4周期;图中离子化合物D:B=1:2,则D为Ca,且B的序数在前面,B为F,C为Cl;A与其他4种元素既不在同一周期又不在同一主族,所以A为H。(2)考查氢键的存在;(3)锰在周期表中的位置,+2价时已经失去个电子,所以排布式为[Ar]3d5;(4)根据晶胞结构可知其含有4个钙离子、8个氟离子,故ρ= ![]() = (40+38)×4÷(6.02×1023)g÷V = a g·cm-3 ,V =
= (40+38)×4÷(6.02×1023)g÷V = a g·cm-3 ,V =![]()
答案:(1)氢。(2)F ;Cl;氟化氢分子间存在氢键,氯化氢分子间没有氢键。(3)四;ⅦB;锰;1s22s22p63s23p63d5。(4)CaF2;![]() 。
。
点评:本题以元素推断为基础,除考查元素名称、位置及电子排布式之外,还设计了有关影响晶体熔沸点高低的原因、晶胞计算等问题。本题的综合性较大,基本上覆盖了物质结构与性质的主干知识。
三、考查影响晶体性质的因素
晶体分为四大类,即原子晶体、离子晶体、分子晶体、金属晶体,其存在的作用力依次是共价键、离子键、分子间作用力、金属键,其强弱影响因素是:共价键主要与原子半径大小、原子间的共用电子对多少有关,可以通过键能来体现;离子键主要由离子半径及其所带电荷数决定,其大小可以通过晶格能来体现;范德华力则主要与相对分子质量有关(氢键则仅存在于含有氢氟键、氢氧键、氢氮键的分子间,强于范德华力,远弱于化学键);金属键则主要与金属阳离子的半径、电荷数有关。
例3、(09江苏![]() )生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
)生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
![]() (1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式 。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式 。
![]() (2)根据等电子原理,写出CO分子结构式 。
(2)根据等电子原理,写出CO分子结构式 。
![]() (3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
![]() ①甲醇的沸点比甲醛高,其主要原因是 ;甲醛分子中碳原子轨道的杂化类型为 。
①甲醇的沸点比甲醛高,其主要原因是 ;甲醛分子中碳原子轨道的杂化类型为 。
![]() ②甲醛分子的空间构型是 ;1 mol甲醛分子中σ键的数目为 。
②甲醛分子的空间构型是 ;1 mol甲醛分子中σ键的数目为 。
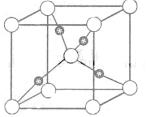
![]()
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为 。
解析:(1)Zn的原子序数为30,注意3d轨道写在4s轨道的前面;(2)依据等电子原理,可知CO与N2为等电子体,N2分子的结构式为:互为等电子体分子的结构相似,可写出CO的结构式;(3)甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸点高;甲醛分子中含有碳氧双键,故碳原子轨道的杂化类型为sp2杂化;分子的空间构型为平面型;1 mol甲醛分子中含有2 mol碳氢δ键,1 mol碳氧δ键,故含有δ键的数目为 3NA;依据晶胞示意图可以看出Cu原子处于晶胞内部,所包含的Cu原子数目为4
答案:(1)![]()
![]() 。(2)
。(2)![]()
![]() ;(3)①甲醇分子之间形成氢键;
;(3)①甲醇分子之间形成氢键;![]() 杂化
杂化![]() ;②平面三角形;3NA
;②平面三角形;3NA![]() ;③4。
;③4。
点评:本题把原子结构、分子结构及晶体结构较好地融合在一起,综合考查了物质结构与性质的主干知识。在第(3)题①中就考查了影响分子晶体沸点高低的因素。
由上可知,考查晶体的知识点都比较简单,命题的形式也是以填空的形式出现的。因此只要我们平时善于归纳判断判断晶体类型的方法,分析影响晶体性质的因素,同时学会灵活运用“均摊法”处理晶胞问题的技巧即可。

- 全部评论(0)
