物质的检验小结
时间:2010-07-26 12:09 来源:未知 作者:郝凯军 点击:次 所属专题: 物质检验
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
物质的检验是高考中的重要题型,通常以鉴定、鉴别和推断等方式考察。依据物质的特殊性质和特殊反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生以及气体、火焰的颜色等,进行判断、推理。常在实验题或选择题中出现。
一、常见气体的检验
1、H2:无色、无味、可燃;①不纯点燃发出爆鸣声;②点燃纯H2,火焰呈淡蓝色,火焰上方罩一干燥烧杯,烧杯壁上有水珠生成:2H2+O2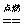 2H2O
2H2O
2、O2:无色无味、能使余烬木条复燃;
3、Cl2:黄绿色刺激性气体有毒;①使湿润淀粉碘化钾试纸变蓝:Cl2+2KI=2KCl+I2 I2遇淀粉变蓝;②使湿润蓝色石蕊试纸先变红后变白:
Cl2+H2O=HCl+HClO HClO强氧化性漂白作用;
4、CO2 :无色无味无毒;①使燃着木条熄灭;②通入澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O
5、CO :无色、无味、剧毒;点燃火焰呈蓝色,火焰上方罩一沾有石灰水液滴的烧杯,液滴变浑浊:2CO+O2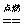 2CO2 CO2+Ca(OH)2=CaCO3↓+H2O
2CO2 CO2+Ca(OH)2=CaCO3↓+H2O
6、NO2 :红棕色气体有刺激性气味、有毒,溶于水、水溶液呈酸性,能使紫色石蕊试液变红:3NO2+H2O=2HNO3+NO
7、NO:无色气体有毒;在空气中立即变为红棕色:2NO+O2=2NO2
8、N2 :无色无味无毒;能使燃着木条熄灭。
9、SO2 :无色有刺激性气味、有毒;①通入品红溶液,品红褪色加热又恢复颜色;②使澄清石灰水变浑浊:SO2+Ca(OH)2=CaSO3+H2O;③使酸性高锰酸钾溶液褪色:5SO2+2MnO4-+ 2H2O =2Mn2++5SO42--+4H+
10、HCl :无色刺激性气味;①能使湿润蓝色石蕊试纸变红:HCl=H++Cl-;②用蘸浓氨水玻璃棒靠近冒白烟:NH3+HCl=NH4Cl;③气体通入HNO3酸化的AgNO3溶液,有白色沉淀生成:HCl+AgNO3=AgCl↓+HNO3 (AgCl不溶于HNO3)
11、H2S:无色臭鸡蛋气味有毒;遇Pb(NO3)2 、(CH3COO)2Pb 、CuSO4溶液均产生黑色沉淀:
Pb2++H2S=PbS↓+2H+;2CH3COO-+Pb2++H2S=PbS↓+2CH3COOH;Cu2++H2S=CuS↓+2H+;
12、NH3:无色刺激性气味;①遇湿润红色石蕊试纸变蓝:NH3+H2O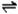 NH3·H2O
NH3·H2O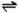 NH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl
NH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl
14、CH4:无色无味、可燃;点燃后火焰呈浅蓝色,火焰上方罩一干燥烧杯,烧杯壁上有水珠罩生成;罩一沾有石灰水液滴的烧杯,液滴变浑浊:CH4+2O2 CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O
CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O
15、C2H4:无色稍有气味;①点燃,火焰明亮(少量黑烟):C2H4+3O2 2CO2+2H2O ;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2==CH2+Br2→CH2Br-CH2Br2
2CO2+2H2O ;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2==CH2+Br2→CH2Br-CH2Br2
16、C2H2:无色无味 ;①点燃火焰明亮并伴有大量黑烟:2C2H2+5O2 4CO2+2H2O ;②使 KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2
4CO2+2H2O ;②使 KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2
小结:①观察法:对于特殊颜色的气体如Cl2(黄绿色)、NO2(红棕色)、碘蒸气(紫红)可据此辨之。②溶解法:根据溶于水的现象不同区分,如NO2和溴蒸气均为红棕色,但溶于水后NO2形成无色溶液;溴形成橙色溶液。③褪色法:SO2和CO2可用品红溶液区分。④氧化法:被空气氧化看变化,如NO的检验。⑤试纸法:如石蕊试纸、醋酸铅试纸。⑥星火发:适用于有助燃性或可燃性的气体检验,如O2使带火星木条复燃;CH4 和C2H2的检验可点燃看现象;CH4、CO、H2则可根据其燃烧产物来判断。
二、几种重要的阳离子的检验
1、焰色反应:Na+:黄色;K+:紫色(透过蓝色钴玻璃观察);Ca2+:砖红色;
2、H+:H+酸性。遇紫色石蕊试液变红,遇湿润蓝色石蕊试纸变红;
3、NH4+:在试液中加强碱(NaOH)加热,产生使湿润红色石蕊试纸变蓝的气体; NH4++OH-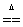 NH3↑+H2O;NH3+H2O
NH3↑+H2O;NH3+H2O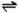 NH3·H2O
NH3·H2O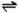 NH4++OH-
NH4++OH-
4、Fe3+ :①通KSCN或NH4SCN溶液呈血红色:Fe3++SCN-==[ Fe(SCN)]2+ ;②通NaOH溶液红褐色沉淀:Fe3++3OH-==Fe(OH)3↓
5、Fe2+ :①遇NaOH溶液生成白色沉淀在空气中迅速转化成灰绿色最后变成红褐色沉淀:Fe3++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O==4Fe(OH)3 ;②试液中加KSCN少量无明显变化再加氯水出现血红色: 2Fe2++Cl2==2Fe3++2Cl-;Fe3++SCN-==[Fe(SCN)]2+
6、Mg2+:遇NaOH溶液有白色沉淀生成,NaOH过量沉淀不溶解:Mg2++2OH-==Mg(OH)2↓,但该沉淀能溶于NH4Cl溶液;
7、Al3+ :遇NaOH溶液(适量)有白色沉淀生成,NaOH溶液过量沉淀溶解:Al3++3OH-==Al(OH)3↓;Al(OH)3+OH-==AlO2-+2H2O
8、Cu2+:遇NaOH溶液有蓝色沉淀生成,加强热变黑色沉淀:Cu2++2OH-==Cu(OH)2↓;Cu(OH)2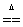 CuO+H2O
CuO+H2O
9、Ba2+ :遇稀H2SO4或硫酸盐溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ba2++SO42-==BaSO4↓
10、Ag+:①加NaOH溶液生成白色沉淀,此沉淀迅速转变为棕色沉淀溶于氨水Ag++OH-==AgOH↓;2AgOH==Ag2O+H2O;AgOH+2NH3·H2O==[ Ag
(NO3)2]OH+2H2O
②加稀HCl或可溶性氧化物溶液再加稀HNO3生成白色沉淀:Ag+ +Cl-==AgCl↓
三、几种重要阴离子的检验
1、OH-:OH-碱性:①遇紫色石蕊试液变蓝;②遇酚酞试液变红;③遇湿润红色石蕊试纸变蓝;
2、Cl-:遇AgNO3溶液有白色沉淀生成,加稀 HNO3沉淀不溶解:Ag++Cl-=AgCl↓
3、Br-:加AgNO3溶液有浅黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++Br-=AgBr↓
4、I-:①加AgNO3溶液有黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++I-=AgI↓;②加少量新制氯水后再加淀粉溶液显蓝色:2I-+Cl2=I2+2Cl-;I2遇淀粉变蓝
5、S2-:①加强酸(非强氧化性)生成无色臭鸡蛋气味气体:S2-+2H+=H2S↑;②遇Pb(NO3)2或(CH3COO)2Pb试液生成黑色沉淀,遇CuSO4试液产生黑色沉淀:Pb2++S2-=PbS↓;Cu2++S2-=CuS↓
6、SO42-:加可溶性钡盐[BaCl2或Ba(NO3)2]溶液有白色沉淀生成后再加稀HCl或稀HNO3沉淀不溶解: Ba2++SO42-=BaSO4↓
7、SO32-:加强酸(H2SO4或HCl)把产生气体通入品红溶液中,品红溶液褪色:SO32-+2H+=H2O+SO2↑ SO2使品红溶液褪色
8、CO32-:加稀HCl产生气体通入澄清石灰水,石灰水变浑浊:CO32-+2H+=H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O
9、HCO3-:取含HCO3-盐溶液煮沸,放出无色无味、使澄清石灰水变浑浊的气体;或向HCO3-溶液里加入稀MgSO4溶液,无现象,加热煮沸有白色沉
淀MgCO3生成,同时放出CO2气体。
10、NO3-:浓缩试液加稀硫酸和铜片加热有红棕色气体产生,溶液变成蓝色:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
11、PO43-:加AgNO3溶液产生黄色沉淀,再加稀HNO3沉淀溶解:3Ag++PO43-=Ag3PO4↓;Ag3PO4溶于稀HNO3酸。
四、几种常见有机物的检验
1、烯烃或炔烃:加少量溴水或酸性高锰酸钾溶液震荡后褪色。
2、苯或苯的同系物:加酸性高锰酸钾,前者不褪色后者褪色。
3、苯酚:加氯化铁溶液呈紫色,加浓溴水生成白色沉淀。
4、醛基:用新制的银氨溶液或新制的Cu(OH)2悬浊液检验,前者有银镜生成,后者有砖红色沉淀生成。
5、淀粉:加碘水变蓝。
6、蛋白质:加硝酸显黄色,灼烧有烧焦羽毛的气味。
五、典型例题剖析
例1:有a、b、c、d.e五种无色气体,进行下列的实验:
|
实验步骤
|
实验现象
|
|
①a和b相混合
|
气体变红棕色
|
|
②c和d相混合
|
产生白烟
|
|
③c、e分别通入少量溴水中
|
溴水都变成无色透明的溶液
|
|
④b、e分别通入氢硫酸中
|
都产生淡黄色的浑浊
|
a、b、c、d、e可能依次是( )。
A.O2、NO、HCl、NH3、CO2 B.O2、NO、NH3、HCl、SO2
C.NO、O2、NH3、HCl、SO2 D.HBr、Cl2、NH3、H2S、C2H4
思路分析:根据表中所给出的两种气体混合后的现象并结合选项中所给出的气体范围进行分析。①a和b混合后气体变红棕色,可能是NO和O2混合反应生成NO2。②c和d混合后产生白烟,可能是NH3气与HCl气混合后反应生成NH4Cl。③c、e分别通入少量溴水中,溴水变成无色透明的溶液,c、e可能是NH3气和SO2气。再结合②可知c是NH3,则e是SO2, d就是HCl。④把b、e分别通人氢硫酸中都产生淡黄色浑浊可得出b、e可能是O2和SO2。由③已得出e是SO2,那么b就是O2。结合①可得出a是NO,从而得出a~e依次是NO、O2、NH3、HCl、SO2
答案:C
点拨:本题主要考查了气体的检验方法和分析推理能力。只有对常见气体的性质及反应非常熟悉,才可能通过分析、对比得出正确结论。
例2:不用其他试剂,用最简单的方法就可以把它们—一鉴别出来,①KOH ②Al2(SO4)3 ③KCl ④FeCl3 ⑤Ba(NO3)2其鉴别过程依次是( )。
A.④①②⑤③ B⑤④③②① C.②③④①⑤ D.①②③④⑤
思路分析:此题中首先确定的是带有颜色的Fe3+盐,然后用它来鉴定KOH,因Fe3+与OH--反应可以产生Fe(OH)3红棕色沉淀,然后再用KOH检验Al3+过量时产生的沉淀消失,则是Al3+转变为AlO2-;再用Al2(SO4)3鉴别Ba(NO3)2产生白色沉淀而不消失,则是Ba2+盐,剩下的那一个没有任何变化的则是KCl。
答案:A
点拨:本题主要考查鉴别物质可先从颜色鉴别,然后根据每种物质的特征性进行鉴别。
例3:有两瓶失去标签的物质的量浓度相同的碳酸钠溶液和碳酸氢钠溶液,请你加以鉴别:
①应选择的一种试剂是( )。
A.氢氧化钠 B.甲苯橙试液 C.稀盐酸 D.澄清石灰水
②简述上述试剂鉴别的实验操作、现象、结论 。
③除上述方法外,你认为是否还有最简单的方法: 。
思路分析:相同浓度的CO32-和HCO3-性质有如下几点区别:(1)与酸反应的速度:HCO3- >CO32-(2)CO32-能与Ba2+(或Cu2+)离子结合成白色沉淀,而HCO3-不能,但若引入OH-,HCO3-也可转化为CO32-,所以,不能用Ca(OH)2或Ba(OH)2区别它们;(3)CO32-水解的碱性比HCO3-强,指示剂变色的程度有所不同,但难以观察,不能用此法鉴别,可用pH试纸检验。
解答:①稀HCl ②将稀HCl分别逐滴加入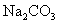 、
、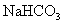 溶液中,产生气体剧烈者是
溶液中,产生气体剧烈者是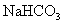 溶液 ③pH试纸。
溶液 ③pH试纸。
点评:实验是对学生综合能力的考查,因此在进行物质检验过程中,元素化合物知识是必不可少的基础。学习过程中还应注意多角度、全方位地进行分析,然后比较其优劣,选择最佳方案。
例4:只用水就能鉴别的一组物质是( )。
A.苯、乙酸、四氯化碳 B.乙醇、乙醛、乙酸 C.乙醛、乙二醇、硝基苯 D.苯酚、乙醇、甘油
思路分析:如乙酸能溶于水,苯、四氯化碳难溶于水,但苯的密度比水的小,而四氯化碳的密度比水的大。因此,可用水来鉴别苯、乙酸、四氯化碳液体。B组三种物质均溶于水,C组前两种物质均溶于水,D组后两种物质溶于水,故B、C、D组物质不能用水来鉴别。
答案:A
点拨:本题主要考查物质在水中的溶解性、溶于水时的热效应、液体的密度等性质都可以作为鉴别一组物质的根据。
例5:现有一定量含有Na2O杂质的Na2O2试样。请从下图中选用适当的实验装置,设计一个最简单的实验,测定 Na2O2试样的纯度。(可供选择的反应物只有CaCO3固体、 6 mol/L的盐酸和蒸馏水)
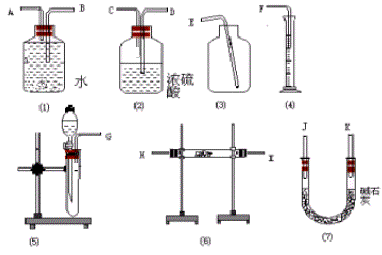
请填写下列空白:
(1)写出在实验中Na2O2和Na2O分别发生反应的化学方程式_____ ______;
(2)应选用的装置是(只要求写出图中装置的标号)_____ ______;
(3)所选用装置的连接顺序是(填各接口的字母,连接胶略)________ _______。
思路分析:根据Na2O2和Na2O的性质,实验方案可能不止一种,这一方面要求我们的思维要具有发散性,另一方面不仅要会设计简单实验,还要会评价实验方案的优劣,从可行方案中选择一个符合题意的最简单的方案。Na2O2可以和水反应生成NaOH和O2,Na2O和水反应生成NaOH;Na2O2和CO2反应生成Na2CO3和O2,Na2O和CO2反应生成Na2CO3,因此选用这两个反应中的任一个,都可以通过测量产物氧气的体积来测定Na2O2的纯度,根据题目要求应采用前一反应,因为根据这一反应原理设计的反应仪器较后一方案简单,选用前一反应方案需要的仪器装置是(5)、(1)、(4)装置的连接顺序是G、A、B 、F。
答案:(1)方程式答案在“思路分析”中;(2)应选用图(5)、图(1)、图(4)装置;(3)其连接顺序是G、A、B、F
点拨:考查学生设计简单实验的能力。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
