氧化还原反应的表示法:单线桥和双线桥解析
时间:2016-01-17 20:34 来源:未知 作者:彭中游 点击:次 所属专题: 双线桥法
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氧化还原反应中电子转移情况有两种表示法:单线桥和双线桥。
(1) 单线桥(也叫单箭号)
意义:表示电子转移的方向和总数(或:表示不同元素原子或离子间电子得失情况)。它体现了“谁给谁”。
表示法:箭号一定在等式左边,箭头上只标明电子转移总数。如:
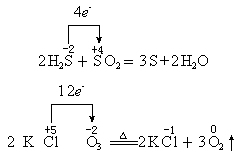
该表示法的特点是:箭头指向的物质为氧化剂。(对于自身氧化还原反应,则箭头指向的元素起氧化作用)
(2) 双线桥(也叫双箭号)
意义:表示同一元素原子或离子间电子得失情况(或:表示电子得与失及氧化、还原过程)。它体现了“谁变谁”。
表示法:箭号一定横跨等式两边,且不少于两根箭号。在箭号上要标上“得到”或“失去”,也可以用“+”或“-”来表示,然后写出具体的电子数目。
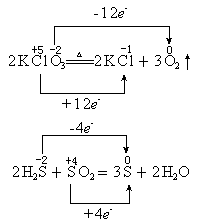
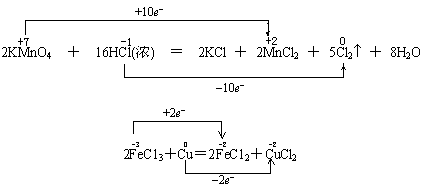
对于分子内的氧化还原反应,特别是歧化反应,使用单线桥不方便,用双线桥好。双线桥易画,但麻烦;单线桥简单,能看出氧化剂。双线桥可用在氧化还原反应方程式配平上。在考试评分中,回答表示氧化还原反应的电子转移方向和数目(或总数)时,使用任一种表示法都算正确。
其实,单线桥和双线桥并不以线桥的多少来划分,有两根或三根线桥的不一定是单线桥,但双线桥却不可能只有一根线桥。因此,要判断是哪种线桥,关键是看线桥是在等式的左边,还是横跨了等式的两边。如:
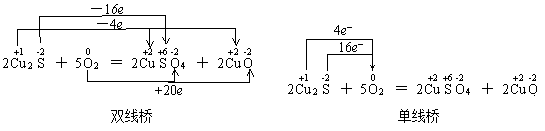
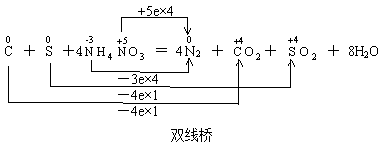
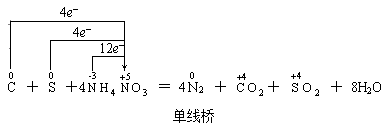
两种表示法也有多种形式,如硫铁矿燃烧的氧化还原反应方程式:
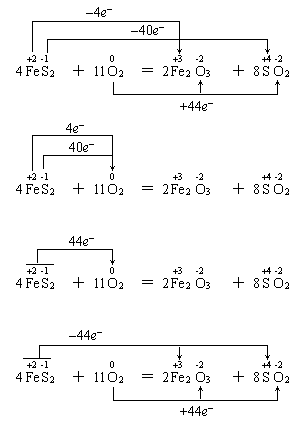
以上分析可以看出,双线桥是分析法,可理解为是微观的;单线桥是综合法,可理解为宏观的。
方法步骤:
(1)标好价:给化合价有变化的元素标好化合价。
(2)列变化:用线桥列出同一元素在化学反应前后化合价的变化,箭头必须由反应物指向生成物,且两端对准同种元素
(3)求总数:求出反应前后得(失)电子的总数
(电子总数=化合价的改变值﹡改变化合价的原子的个数)
(4)查守恒:检查得失电子的总数是否相等
要注意,以下容易标错的氧化还原反应方程式。
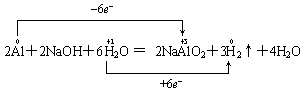
如铝与NaOH溶液反应,把NaOH当成氧化剂,且标示如下是错的:
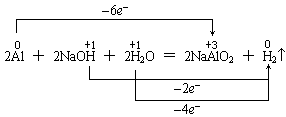
因为该化学方程式是总反应方程式,反应过程是铝先与水反应生成氢氧化铝和氢气,然后氢氧化铝和碱反应生成偏铝酸钠和水,前者是置换反应,水是氧化剂;后者是复分解反应,NaOH作为碱与酸反应,并不是氧化剂。正确的应是如下表示法:
又如浓硫酸与硫化氢反应,如下表示是错的:
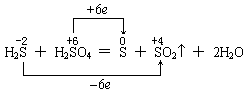
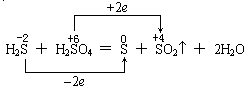
因为氧化还原反应是逐步氧化和逐步还原的,即 -2价的S首先变成0价的S,再氧化才升高到+4价的S,直到氧化为+6价的S;同理,+6价的S首先被还原,变成+4价的S,再还原降到0价的S,直至还原到-2价的S。故应如下表示才正确:
再如HCl和KClO3反应,如下表示也是错的:
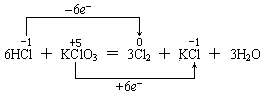
因为氧化还原反应有条规律是:只有同一种元素发生的氧化还原反应时,该元素的化合价变化是“只相撞,不相交”。故下列表示法才是正确的。
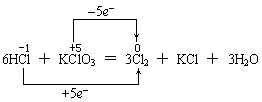
学生在书写这两种表示法时常出现以下的问题:
① 没有箭头,或两边都打上箭头。这是因为没有弄清楚箭头指向表示了电子转移的方向,或从元素的什么价态变成了什么价态。
② 在单线桥上标“得到”或“失去”(或用“+”、“-”表示),或在双线桥上又不写出“得到”或“失去”(或用“+”、“-”表示)。这反映了学生没有理解两种线桥的含义。
③ 在双线桥中,箭头和箭尾指向了不同的元素。这也是没有理解双线桥的含义。
④ 涉及多个元素发生氧化还原反应时,得电子和失电子的情况没分开在上下标出,不容易看出得电子总数和失电子总数的情况,给自己造成不必要的麻烦。
练习:
以下化学方程式可作配平练习:
2Na2O2+2CO2=2Na2CO3+O2
3Fe(NO3)2+9HNO3=3Fe(NO3)3+NO+2H2O
2Mn(NO3)2+5PbO2+6HNO3=2HMnO4+5Pb(NO3)2+2H2O
2Ag3AsO4+11Zn+11H2SO4=6Ag+11ZnSO4+2AsH3+3H2O
8KMnO4+11NaOH+PH3=4K2MnO4+4NaMnO4+Na3PO4
K2Cr2O7+6Fe3O4+31H2SO4=Cr2(SO4)3+9Fe(SO4)3

- 全部评论(0)
(2294415102) 评论 氧化还原反应的表示法:单:谢谢你的帮助
