理想气体状态方程
时间:2022-08-12 07:48 来源:摘抄于因特网 作者:黄晓东 点击:次 所属专题: 气体状态方程
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在一定温度和压力下,物质总是以一定的聚集状态存在。即存在为气态、液态或固态,条种状态都各有其特性。在一定条件下,物质总是以一定的聚集状态参加化学反应的。物质的状态(state of matter)对其化学行为是有重要影响的。对于给定的反应,由于物质的状态不同,反应的速度和反应的能量关系也有所不同,还会影响反应条件。本章将叙述气体的特性。
气体的特征是具有扩散性和压缩性(diffusivity and compressibility)。将气体引入任何大小的容器中,由于气体分子的能量大,分子间引力小,分子在作无规则地运动,因而能自动扩散充满整个容器。因此,气体没有一定的体各和形状。又因为气体分子间的空隙很大,对气体加压,其体积就缩小。同时气体还受到温度、气体的量的影响。通常一定量的气体所处状态可以用压力(pressure)、体积(volume)、温度(temperature)来描述。而反应这四个量的关系的式子就是气体的状态方程式。
一般气体,在密度不太高、压强不太大(与大气压比较)和温度不太低(与室温比较)的实验范围内,遵守玻意耳(Boyle)定律、盖-吕萨克(Gay Lussac)和查理(Charles)定律。应该指出,对不同气体来说,这三条定律的适用范围是不同的,不易液化的气体,例如氮气、氢气等适用的范围比较大,而氨气的适用范围就要小得多。实际上在任何情况下都服从上述三条理论定律的气体是没有的。我们把实际气体抽象化,提出理想气体的概念,认为理想气体能无条件地服从这三条定律。在这种情况下,理想气体的状态函数p、V、T 之间的关系即理想气体的状态方程。
可以从这三条定律导出当物质的量为n 的理想气体处于平衡态时,它的状态方程就是:pv=nRT
其中包括了气体的三个状态量:p——压强(千帕斯卡);V——体积(立方分米);T——气体的热力学温度(开尔文)。
这个方程就是理想气体的状态方程(equation of state of ideal gas),只有理想气体才完全遵守这个关系式。而对于真实气体,必须考虑到分子间的作用力和分子本身体积,将理想气体状态方程式修正后才能应用。
现在我们要关心的问题是式中的常数 R,要应用这个方程必须要求出 R。这个常数被称为气体常数,它是由实验测得的。将具有一定物质的量的气体的三个状态量,即压强、体积和温度代入方程就可以求出气体常数。本章附录中的气体常数测定实验就是用一定量的镁与酸作用,生成的氢气体积用量气管测定。所得的数据代入方程就得到了气体常数的值。
这里我们用理论值推导气体常数。在标准状况下,即 273.15K,101.325kPa 时,1mol 气体占有的体积是 22.414L。将上述数据代入方程中:
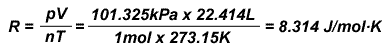
8.314 就是气体常数的理论值。在附录中做出的实验可以与理论值有出入,这是由于实验测定的是真实气体。只要真实气体的压强越小,温度越高就越是接近气体常数的理论值。要注意气体常数的单位是焦尔。以后的热力学内容中要用到气体常数。由于热力学常用千焦作单位,要使用公式时作到单位统一。

- 全部评论(0)
