碳及其化合物的结构和性质知识点总结
时间:2023-08-13 16:08 来源:未知 作者:化学自习室 点击:次 所属专题: 碳及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、单质碳的结构和性质
1、碳元素的存在形态
(1)游离态:金刚石、石墨
(2)化合态:二氧化碳、碳酸钠、淀粉、纤维素
2、碳元素的作用
(1)形成化合物种类最多的元素
(2)构成生物体的基本元素
(3)构成地壳中岩石和化石燃料的主要元素
3、碳的三种同素异形体
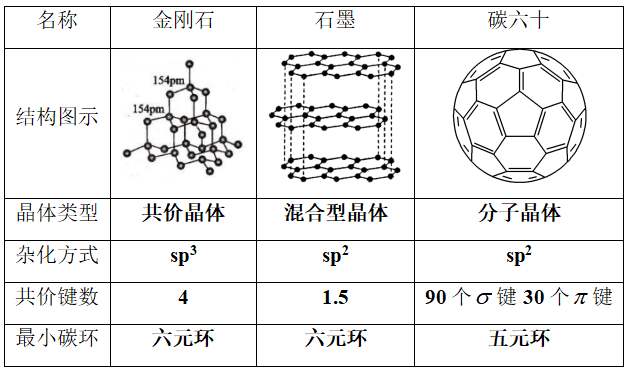
4、几种常见的碳单质的用途
(1)木炭:制黑火药
(2)活性炭:防毒面具
(3)石墨:制作电极
(4)焦炭:冶炼金属
(5)金刚石:切割玻璃
(6)炭黑:制造油墨
5、化合价:最高正价为+4,最低负价为-4
6、碳的还原性
(1)可燃性:
![]()
(2)与氧化物的反应
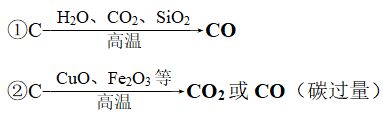
(3)与氧化性酸的反应
①浓硝酸:
![]()
②浓硫酸:
![]()
二、一氧化碳的结构和性质
1、结构
(1)结构式:
![]() ,
,
电子式:
![]()
(2)化学键
①按共用电子对来源:共价键和配位键
②按电子云重叠程度:
![]()
2、毒性:
与血红蛋白(HB)通过配位键结合,使其失去携氧功能,同NO
(1)提供孤电子对的原子:C
(2)配合物稳定性:
![]()
3、还原性(高温还原剂)
(1)可燃性:
![]()
①蓝色火焰:CO燃烧
②淡蓝色火焰:氢气、甲烷、酒精燃烧、硫在空气中燃烧
③蓝紫色火焰:硫在纯氧中燃烧
④紫色火焰:钾元素的焰色试验
⑤黄色火焰:钠元素的焰色试验
⑥苍白色火焰:氢气在氯气中燃烧
(2)还原氧化物:
![]()
4、工业制法:
![]() 吸热反应
吸热反应
三、实验室制一氧化碳
1、反应原理及装置
(1)装置类型:
![]()
①反应:
![]()
②信息:H2C2O4·2H2O在101.5℃熔化,150℃左右分解
(2)装置类型:
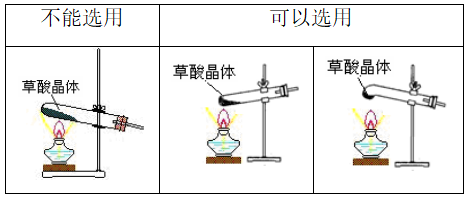
![]()
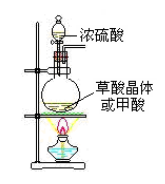
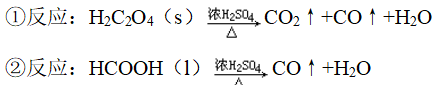
③浓硫酸的作用:催化剂和脱水剂
2、气体净化装置(假设含CO2和H2O杂质)
(1)先用NaOH溶液除CO2
(2)再用浓硫酸或P2O5或硅胶或无水CaCl2或碱石灰除水蒸气
(3)最好用碱石灰将二者全部除去
3、气体收集装置:只能用排水法
4、检验方法
(1)图示
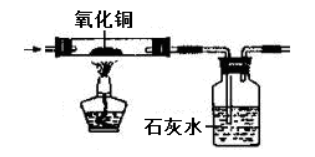
(2)方法:先将气体通过灼热的CuO,变红,再将产生的气体通入澄清石灰水,变浑浊
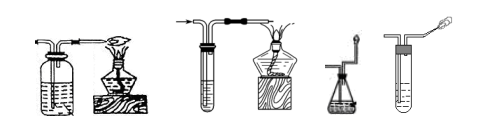
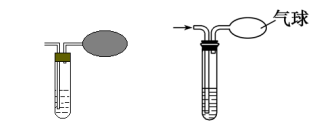
5、尾气处理
(1)点燃法
(2)袋装法
(3)强氧化剂法(信息型)
①银氨溶液:
![]()
②PdCl2溶液:
![]()
③热的高锰酸钾溶液:
![]()
6、CO还原CuO的实验
(1)开始时
①先点燃酒精灯B(尾气处理)
②再通入CO排尽装置内的空气,防止不纯的CO在点燃时发生爆炸
③最后点燃酒精灯A,进行CO还原CuO的实验
(2)结束时
①先熄灭酒精灯A,停止反应
②再停止通入CO,防止水倒吸入热的硬质玻璃管中使其炸裂
③最后熄灭酒精灯B
7、确定CO、CO2混合气体中含有CO的实验
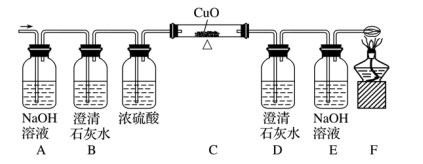
(1)各装置的作用
①A装置:除去混合气体中的CO2气体。
②B装置:检验混合气体中的CO2是否除尽。
③C装置:检验气体有无还原性或初步检验是否有CO
④D装置:检验有无CO2生成,进一步确认是否有CO
⑤E装置:除去尾气中的CO2气体。
⑥F装置:除去尾气中的CO气体、防止污染空气。
(2)确定有CO的现象:B中无明显现象,C中的物质由黑色变成红色,D中的澄清石灰水变浑浊
四、二氧化碳的结构和性质
1、分子结构
(1)结构式:
![]()
(2)共价键:
![]()
(3)分子类型:非极性分子
(4)晶胞结构
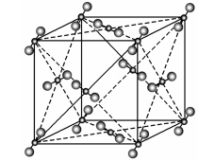
①晶胞名称面心立方,配位数12
②中心原子的杂化方式sp
2、物理性质
(1)溶解性:可溶于水(1∶1),不溶于饱和NaHCO3溶液
(2)固体CO2俗称干冰,可用于人工降雨
3、酸性氧化物
(1)与碱溶液反应
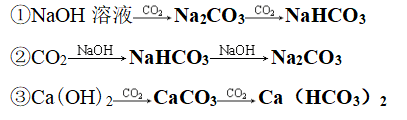
(2)与碱性氧化物反应
![]()
4.氧化性
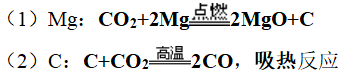
5、工业制法:
![]() ,吸热反应
,吸热反应
6、CO2在自然界中的循环
(1)CO2的主要来源:大量含碳燃料的燃烧。
(2)自然界消耗CO2的主要反应:
①溶于江水、海水中:CO2+H2O===H2CO3
②光合作用将CO2转化为O2;
③岩石的风化:CaCO3+H2O+CO2===Ca(HCO3)2。
五、CO2与常见盐溶液的反应
1、CO2与弱酸盐溶液的反应:同时满足“强酸制弱酸,强碱制弱碱”原理

2、与CO2量无关的酸式盐
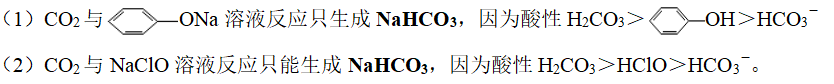
3、CO2与饱和Na2CO3溶液反应
(1)现象:有白色晶体析出
(2)反应:![]()
(3)原因:NaHCO3的溶解度比Na2CO3的小,而且反应消耗水
4.CO2通入CaCl2或BaCl2溶液不会产生白色沉淀,因为碳酸的酸性弱于盐酸。
六、实验室制二氧化碳
1、制备原理
(1)碳酸钙和稀盐酸:
![]()
(2)不用大理石和稀硫酸的原因:在CaCO3表面生成微溶的CaSO4沉淀,阻止反应继续进行
2、发生装置:“块状固体+液体→气体”型
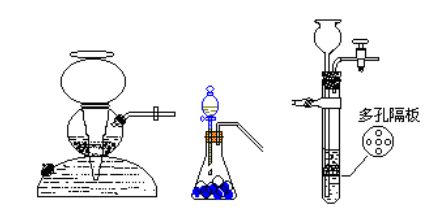
3、气体净化装置
(1)试剂:先用饱和NaHCO3溶液除去HCl,再用浓硫酸、P2O5、硅胶、无水CaCl2除去水蒸气
(2)装置:洗气瓶,导气管口长进短出
4、气体收集装置
(1)排空气法:向上排空气法
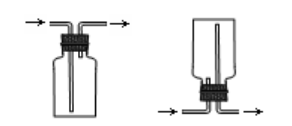
①带橡胶塞的集气瓶正放:导气管口长进短出
②带橡胶塞的集气瓶倒放:导气管口短进长出
(2)排液体法:排饱和NaHCO3溶液法,导气管口短进长出
5、检验方法:
先将气体通入品红溶液,不褪色;再通入澄清石灰水,变浑浊
6、注意事项
(1)稀盐酸应从长颈漏斗加入,长颈漏斗的下端管口要伸入液面以下,防止反应生成的气体从长颈漏斗逸出
(2)不能用酒精灯加热制CO2
(3)不可用稀硫酸和大理石或石灰石反应,会生成微溶性固体硫酸钙,它覆盖在大理石
或石灰石表面,阻止反应的进行
(4)不可用硝酸与大理石或石灰石反应,由于硝酸是一种不稳定性的酸,在见光或受热
时易分解,从而使制得的CO2,中混有NO2和O2等杂质。
(5)不易用浓盐酸和大理石或石灰石反应,由于浓盐酸具有挥发性,使制得的CO2中混
有较多的氯化氢气体,可用饱和碳酸氢钠溶液除去
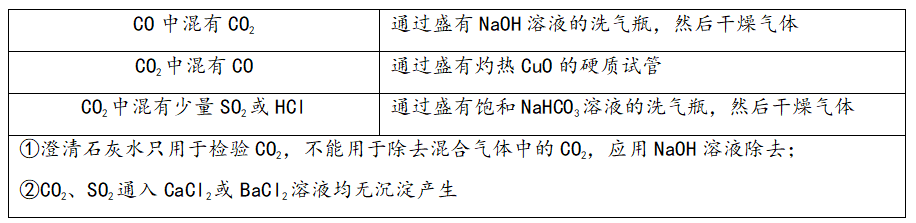
七、CO、CO2气体的除杂方法
八、碳酸
1、物理性质:
弱酸性、不稳定性。碳酸(H2CO3)只能在水中存在。H2CO3在水中与CO2共存,因此常把CO2+H2O当碳酸用。
2、碳酸的酸式盐和正盐的比较
(1)在水中的溶解性
①含K+、Na+、NH4+的正盐易溶于水,其余一般不溶于水;酸式盐均能溶于水。
②一般来说,在相同温度下,难溶性正盐溶解度小于其酸式盐溶解度,如溶解度Ca(HCO3)2>CaCO3;可溶性正盐溶解度大于其酸式盐溶解度,如溶解度Na2CO3>NaHCO3。
(2)水溶液酸碱性强弱
物质的量浓度相同时,正盐溶液的pH大于其酸式盐溶液,如pH:Na2CO3溶液>NaHCO3溶液。
(3)热稳定性
一般来说,热稳定性顺序为正盐>酸式盐>碳酸,如稳定性Na2CO3>NaHCO3>H2CO3。可溶性正盐>难溶性正盐,如CaCO3高温分解,而K2CO3不易分解。
(4)与酸的反应

(5)与碱的反应
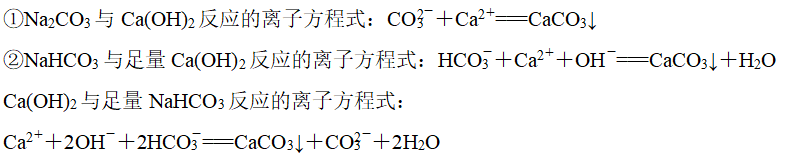

- 全部评论(0)
