2025年陕西、山西、宁夏、青海高考化学试题(非选择题)
时间:2025-06-18 11:36 来源:未知 作者:化学自习室 点击:次 所属专题: 新高考题库
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
二、非选择题:本题共4小题,共58分。
【2025陕晋宁青等级考】15. 某实验室制备糖精钴[Co(Sac)2(H2O)4].xH2O,并测定其结晶水含量。
已知:Sac-表示糖精根离子,其摩尔质量为182g/mol,糖精钴的溶解度在热水中较大,在冷水中较小;丙酮沸点为56℃,与水互溶。
CoCl2·6H2O+NaSac.2H2O=[Co(Sac)2(H2O)4].xH2O+(6-x)H2O+2NaCl
(一)制备
I.称取1.0g CoCl2·6H2O,加入18mL蒸馏水,搅拌溶解,得溶液1。
Ⅱ.称取2.6g(稍过量)糖精钠(NaSac.2H2O),加入10mL蒸馏水,加热搅拌,得溶液2。
Ⅲ.将溶液2加入到接近沸腾的溶液1中,反应3分钟后停止加热,静置,冷却结晶。
Ⅳ.过滤,依次用三种不同试剂洗涤晶体,晾干得产品。
回答下列问题:
(1)I和Ⅱ中除烧杯外,还需用到的玻璃仪器有_______、_______(写出两种)
(2)Ⅲ中静置过程有少量晶体出现时,可将烧杯置于_______中,以使大量晶体析出。
(3)Ⅳ中用①丙酮、②冷水、③冷的1%NaSac溶液洗涤晶体,正确顺序为_______。
A.①③② B.③②① C.②①③
(4)Ⅳ中为了确认氯离子己经洗净,取水洗时的最后一次滤液于试管中,_______(将实验操作、现象和结论补充完整)。
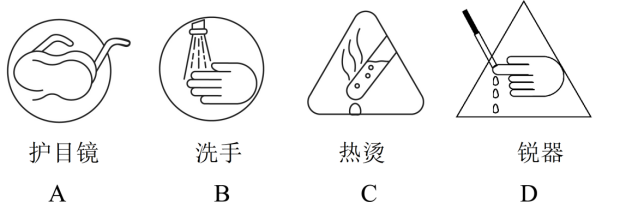
(5)与本实验安全注意事项有关的图标有_______。
(二)结晶水含量测定
EDTA和Co2+形成1:1配合物。准确称取m g糖精钴产品于锥形瓶中,加蒸馏水,加热溶解,再加入缓冲溶液和指示剂,在50~60℃下,用c mol/L的EDTA标准溶液滴定。
(6)下列操作的正确顺序为_______(用字母排序)。
a.用标准溶液润洗滴定管 b.加入标准溶液至“0”刻度以上2~3mL处
c.检查滴定管是否漏水并清洗 d.赶出气泡,调节液面,准确记录读数
(7)滴定终点时消耗标准溶液V mL,则产品[Co(Sac)2(H2O)4].xH2O中x的测定值为_______(用含m、c、V的代数式表示);若滴定前滴定管尖嘴处无气泡,滴定后有气泡,会导致x的测定值_______(填“偏高”“偏低”或“无影响”)。
【答案】(1) ①. 玻璃棒 ②. 量筒(或胶头滴管等,合理即可) (2)冰水浴 (3)B
(4)加稀硝酸酸化,再滴加AgNO3溶液,无白色沉淀生成,说明Cl-已洗净 (5)ABC (6)cabd
(7) ①. 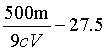 (或:
(或: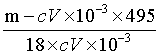 ) ②. 偏高
) ②. 偏高
【解析】
【分析】按照反应CoCl2·6H2O+NaSac.2H2O=[Co(Sac)2(H2O)4].xH2O+(6-x)H2O+2NaCl制备糖精钴,然后在冰水浴中结晶,再按照“冷的1% NaSac溶液、冷水、丙酮”顺序进行洗涤,得到糖精钴晶体,最后将糖精钴晶体溶解后用EDTA标准溶液滴定测定含有结晶水的数量。
【小问1详解】
步骤I、Ⅱ中需要使用量筒、胶头滴管量取蒸馏水,并用玻璃棒搅拌以加快固体溶解速率。
【小问2详解】
因为糖精钴在冷水中溶解度较小,所以为了尽快让大量晶体析出,应降低溶液温度,可将烧杯置于冰水浴中。
【小问3详解】
先用冷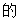 1% NaSac溶液洗涤,可降低糖精钴溶解度,减少晶体损失,还能将晶体表面吸附的Co2+转化为晶体析出,且不引人新的杂质,再用冷水洗涤,可降低晶体溶解度并洗去溶液中存在的可溶性离子,丙酮可以与水互溶且沸点比关键水的低,故最后用丙酮洗涤以除去残留的水且能使晶体快速干燥,故答案为B。
1% NaSac溶液洗涤,可降低糖精钴溶解度,减少晶体损失,还能将晶体表面吸附的Co2+转化为晶体析出,且不引人新的杂质,再用冷水洗涤,可降低晶体溶解度并洗去溶液中存在的可溶性离子,丙酮可以与水互溶且沸点比关键水的低,故最后用丙酮洗涤以除去残留的水且能使晶体快速干燥,故答案为B。
【小问4详解】
Ⅳ中为了确认氯离子己经洗净的步骤为:取水洗时的最后一次滤液于试管中,加稀硝酸酸化,再滴加AgNO3溶液,无白色沉淀生成,说明Cl-已洗净。
【小问5详解】
进行化学实验需要佩戴护目镜,以保护眼睛,同时化学实验结束后,离开实验室前需用肥皂等清洗双手,该实验涉及加热操作,因此需要防止热烫,要选择合适的工具进行操作,避免直接触碰,故A、B、C符合题意;该实验中未涉及锐器的操作,D不符合题意,故答案为ABC。
【小问6详解】
使用滴定管前首先要检漏,确定不漏液之后用蒸馏水清洗(c),再用待装的标准溶液进行润洗(a),待润洗完成后 装入标准溶液至“0”刻度以上2~3 mL处(b),放液赶出气泡后调节液面至“0”刻度或“0”刻度下,准确记录标准溶液体积的初始读数(d),故答案为cabd。
【小问7详解】
滴定消耗的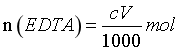 ,EDTA与Co2+形成1:1配合物,则样品溶解后的
,EDTA与Co2+形成1:1配合物,则样品溶解后的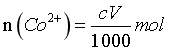 ,即样品中的
,即样品中的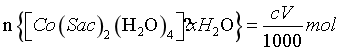 ,而
,而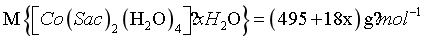 ,所以
,所以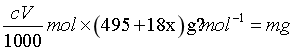 ,解得
,解得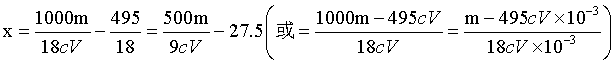 ;若滴定前滴定管尖嘴处无气泡,滴定后有气泡,测得消耗EDTA溶液体积偏小,即V偏小,根据
;若滴定前滴定管尖嘴处无气泡,滴定后有气泡,测得消耗EDTA溶液体积偏小,即V偏小,根据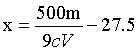 ,则x偏高。
,则x偏高。
【2025陕晋宁青等级考】16. 一种综合回收电解锰工业废盐(主要成分为Mn2+、Mg2+、NH4+的硫酸盐)的工艺流程如下。
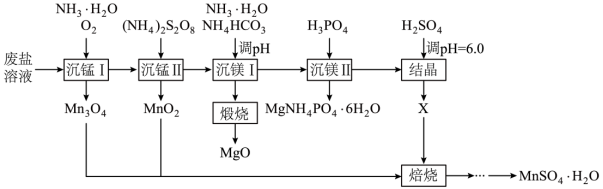
已知:①常温下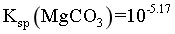 ,
,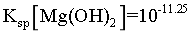 ,
,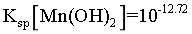 ;
;
②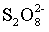 结构式为
结构式为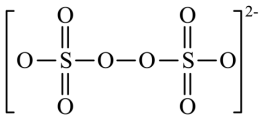 。
。
回答下列问题:
(1)制备废盐溶液时,为加快废盐溶解,可采取的措施有_______、_______。(写出两种)
(2)“沉锰I”中,写出形成的Mn(OH)2被氧化成Mn3O4的化学方程式_______。当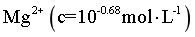 将要开始沉淀时,溶液中剩余Mn2+浓度为_______mol/L。
将要开始沉淀时,溶液中剩余Mn2+浓度为_______mol/L。
(3)“沉锰Ⅱ”中,过量的(NH4)2S2O8经加热水解去除,最终产物是NH4HSO4和_______(填化学式)。
(4)“沉镁I”中,当pH为8.0~10.2时,生成碱式碳酸镁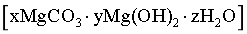 ,煅烧得到疏松的轻质MgO。pH过大时,不能得到轻质MgO的原因是_______。
,煅烧得到疏松的轻质MgO。pH过大时,不能得到轻质MgO的原因是_______。
(5)“沉镁Ⅱ”中,加H3PO4至pH=8.0时,Mg2+沉淀完全;若加至pH=4.0时沉淀完全溶解,据图分析,写出沉淀溶解的离子方程式_______。
(6)“结晶”中,产物X的化学式为_______。
(7)“焙烧”中,Mn元素发生了_______(填“氧化”或“还原”)反应。

【答案】(1) ①. 搅拌 ②. 适当升温等
(2) ①. 6Mn(OH)2+O2=2Mn3O4+6H2O ②. 10-2.15
(3)O2 (4)pH过大,沉淀为Mg(OH)2,不能分解产生CO2,不能得到疏松的轻质MgO
(5)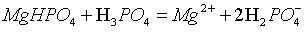
(6)(NH4)2SO4
(7)还原
【解析】
【分析】废盐溶液加入氨水,通入氧气沉锰I得到Mn3O4,溶液再加入(NH4)2S2O8,进行沉锰Ⅱ得到MnO2,产生有气体O2,溶液再加入NH4HCO3和NH3·H2O调节pH沉镁I,得到MgCO3,煅烧得到MgO,溶液再加入H3PO4沉镁Ⅱ,得到MgNH4PO4·6H2O沉淀,溶液加入H2SO4调节pH=6.0结晶得到X硫酸铵,最后与MnO2和Mn3O4焙烧,经过多步处理得到MnSO4·H2O。
【小问1详解】
加快废盐的溶解可以采取搅拌、适当升温、粉碎等;
【小问2详解】
Mn(OH)2被O2氧化得到Mn3O4,化学方程式为:6Mn(OH)2+O2=2Mn3O4+6H2O;
根据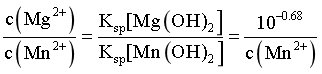 =
=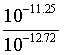 ,
,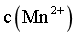 =10-2.15mol/L;
=10-2.15mol/L;
【小问3详解】
“沉锰Ⅱ”中,过量的(NH4)2S2O8经加热水解去除,(NH4)2S2O8中存在过氧键,在加热和水存在下发生水解,生成NH4HSO4和H2O2:(NH4)2S2O8+2H2O=NH4HSO4+H2O2,h2o2分解2H2O2=2H2O+O2↑,总反应为2(NH4)2S2O8+2H2O = 4NH4HSO4+O2↑,最终产物是和和O2;
【小问4详解】
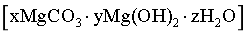 煅烧有CO2生成,可以得到疏松的轻质氧化镁,pH过大,沉淀为Mg(OH)2,不能分解产生CO2,不能得到疏松的轻质MgO;
煅烧有CO2生成,可以得到疏松的轻质氧化镁,pH过大,沉淀为Mg(OH)2,不能分解产生CO2,不能得到疏松的轻质MgO;
【小问5详解】
由图可知,pH=8时,阴离子为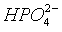 ,阳离子为Mg2+,产生的沉淀为MgHPO4,调节到pH=4,磷元素存在形式为
,阳离子为Mg2+,产生的沉淀为MgHPO4,调节到pH=4,磷元素存在形式为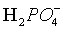 ,磷酸不是强酸,不能拆,离子方程式为:
,磷酸不是强酸,不能拆,离子方程式为: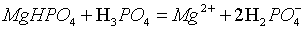 ;
;
【小问6详解】
溶液中存在铵根离子和硫酸根离子,结晶后X为(NH4)2SO4;
【小问7详解】
“焙烧”中,Mn3O4和MnO2最终生成MnSO4·H2O,Mn元素化合价降低,发生了还原反应。
【2025陕晋宁青等级考】17. MgCO3/MgO循环在CO2捕获及转化等方面具有重要应用。科研人员设计了利用MgCO3与H2反应生成CH4的路线,主要反应如下:
I.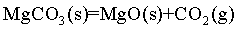
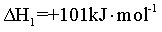
II.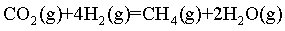
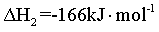
III.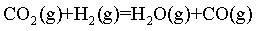
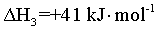
回答下列问题,
(1)计算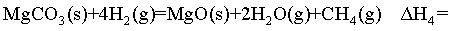 _______
_______ 。
。
(2)提高CH4平衡产率的条件是_______。
A. 高温高压 B. 低温高压 C. 高温低压 D. 低温低压
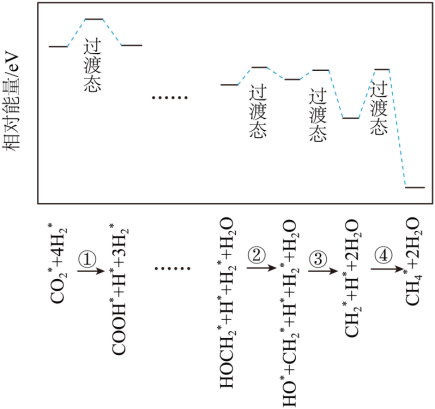
(3)高温下MgCO3分解产生的MgO催化CO2与H2反应生成CH4,部分历程如图,其中吸附在催化剂表面的物种用*标注,所示步骤中最慢的基元反应是_______(填序号),生成水的基元反应方程式为_______。
(4)100KPa下,在密闭容器中H2(g)和MgCO3(s)各1mol发生反应。反应物(H2、MgCO3)的平衡转化率和生成物(CH4、CO2)的选择性随温度变化关系如下图(反应III在360℃以下不考虑)。
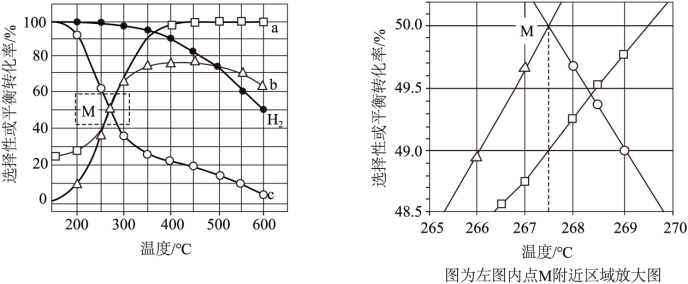
注:含碳生成物选择性
①表示CH4选择性的曲线是_______(填字母)。
②点M温度下,反应Ⅱ的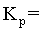 _______
_______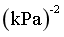 (列出计算式即可)。
(列出计算式即可)。
③在550℃下达到平衡时,n(CO)=_______mol。500~600℃,随温度升高H2平衡转化率下降的原因可能是_______。
【答案】(1)-65 (2)B
(3) ①. ④ ②. HO*+H2*+CH2*= CH3*+H2O
(4) ①. c ②. 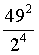 ③. 0.2 ④. 反应Ⅱ生成的氢气多于反应Ⅲ消耗的氢气
③. 0.2 ④. 反应Ⅱ生成的氢气多于反应Ⅲ消耗的氢气
【解析】
【小问1详解】
已知:
I.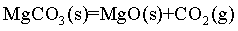
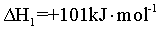
Ⅱ.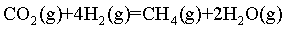
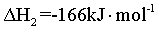
将I+ Ⅱ可得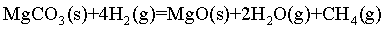
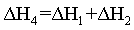 =
=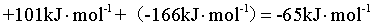 ,故答案
,故答案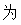 :-65;
:-65;
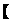 小问2详解】
小问2详解】
已知反应Ⅱ.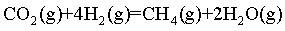
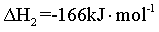 为放热反应,要提高CH4平衡产率,要使平衡正向移动。
为放热反应,要提高CH4平衡产率,要使平衡正向移动。
A.高温会使平衡逆向移动,不利于提高CH4平衡产率,A错误;
B.低温使平衡正向移动,高压也使平衡正向移动,可提高CH4平衡产率,B正确;
C.高温会使平衡逆向移动,低压会使平衡逆向移动,不利于提高CH4平衡产率,C错误;
D.低压会使平衡逆向移动,不利于提高CH4平衡产率,D错误;
故选B。
【小问3详解】
反应活化能越高,反应速率越慢,从图中可以看出,第四部活化能最高,速率最慢,基元反应为CH3*+H*+2H2O=CH4*+2H2O;由图可知,在第三步时生成了水,基元反应为:HO*+H2*+CH2*= CH3*+H2O,故答案为:④;HO*+H2*+CH2*= CH3*+H2O;
【小问4详解】
已知反应I为吸热反应, Ⅱ为放热反应,III为吸热反应,根据图像,温度逐渐升高,则碳酸镁的转化率逐渐升高,氢气的转化率下降,在360℃以下不考虑反应Ⅲ,则二氧化碳的选择性上升,甲烷的选择性下降,所以a表示碳酸镁的转化率,b表示二氧化碳的选择性,c表示甲烷的选择性。
①表示CH4选择性的曲线是c,故答案为:c;
②点M温度下,从图中看出碳酸镁的转化率为49%,则剩余的碳酸镁为0.51mol,根据碳原子守恒,甲烷和二氧化碳中碳原子的物质的量之和为0.49mol,又因为此时二氧化碳的选择性和甲烷的选择性相等,则二氧化碳和甲烷的物质的量为0.245mol,根据氧原子守恒得出水的物质的量为0.49mol,根据氢原子守恒得出 氢气的物质的量为0.02mol,总的物质的量为0.02+0.245+0.245+0.49=1mol,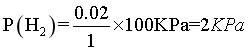 ,
,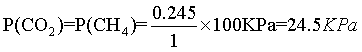 ,
,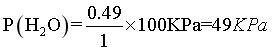 ,则反应Ⅱ的
,则反应Ⅱ的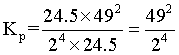 ,故答案为:
,故答案为: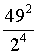 ;
;
③在550℃下达到平衡时,碳酸镁完全转化,二氧化碳的选择性为70%,甲烷的选择性为10%,则生成的二氧化碳为0.7mol,生成的甲烷为0.1mol,根据碳原子守恒得出n(CO)=1-0.7-0.1 mol=0.2mol;因为反应Ⅱ是放热的,反应Ⅲ是吸热的。在500~600℃,随温度升高,反应Ⅱ逆向移动,反应Ⅲ正向移动,由于反应Ⅱ生成的氢气多于反应Ⅲ消耗的氢气,导致H2平衡转化率下降,故答案为:0.2;反应Ⅱ生成的氢气多于反应Ⅲ消耗的氢气。
【2025陕晋宁青等级考】18. 我国某公司研发的治疗消化系统疾病的新药凯普拉生(化合物H),合成路线如下(部分试剂、反应条件省略)。
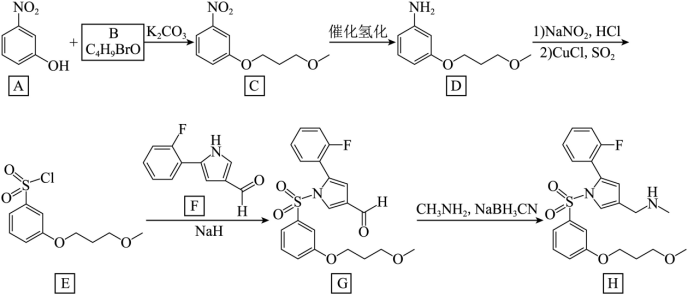
已知: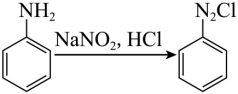
回答下列问题:
(1)A中官能团的名称是_______。
(2)B的结构简式为_______。
(3)由C转变为D的反应类型是_______
(4)同时满足下列条件的B的同分异构体有_______种(不考虑立体异构)。
①含有两个甲基;②与钠反应产生氢气。
(5)由D转变为E的过程中经历了两步反应,第一步反应的化学方程式是:_______(要求配平)。
(6)下列关于F说法正确的有_______。
A. F能发生银镜反应
B. F不可能存在分子内氢键
C. 以上路线中E+F→G 的反应产生了氢气
D. 已知醛基吸引电子能力较强,与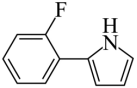 相比F的N-H键极性更小
相比F的N-H键极性更小
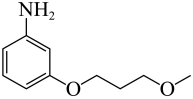
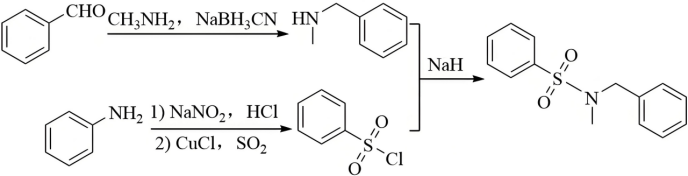
(7)结合合成H的相关信息,以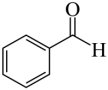 、
、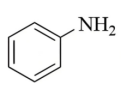 和含一个碳原子的有机物(无机试剂任选)为原料,设计化合物
和含一个碳原子的有机物(无机试剂任选)为原料,设计化合物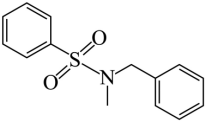 的合成路线_______。
的合成路线_______。
【答案】(1)硝基、羟基
(2) (3)还原反应 (4)5
(3)还原反应 (4)5
(5) +NaNO2+2HCl
+NaNO2+2HCl
 +NaCl+2H2O (6)AC
+NaCl+2H2O (6)AC
(7)
【解析】
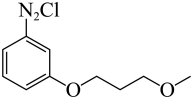
【分析】A和B发生反应生成C,K2CO3的作用是与A和B反应生成的HBr反应,促进反应正向进行,结合B的分子式C4H9BrO,以及C的结构简式,可知B的结构简式为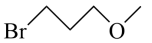 ,C中硝基还原为氨基生成D,D经历两步反应生成E,E发生取代反应生成G,据此解答。
,C中硝基还原为氨基生成D,D经历两步反应生成E,E发生取代反应生成G,据此解答。
【小问1详解】
结合A的结构简式可知,官能团的名称是,硝基、羟基;
【小问2详解】
由分析可知,B的结构简式为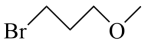 ;
;
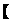 小问3详解】
小问3详解】
C中硝基还原为氨基生成D,反应类型是还原反应;
【小问4详解】
B的分子式C4H9BrO,含有两个甲基,与与钠反应产生氢气,则官能团为碳溴键和羟基,采用“定一移的方法”共有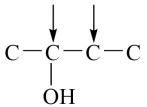 、
、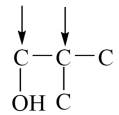 、
、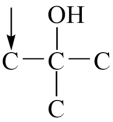 (箭头所指溴原子位置),共有5种;
(箭头所指溴原子位置),共有5种;
【小问5详解】
由D转变为E的第一步反应是已知条件的反应,化学方程式为: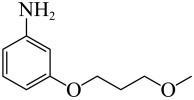 +NaNO2+2HCl
+NaNO2+2HCl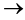
 +NaCl+2H2O;
+NaCl+2H2O;
【小问6详解】
A.F中含有醛基,能发生银镜反应,A正确;
B.F中亚氨基上的H原子与F原子距离较近,能形成分子内氢键,B错误;
C.E与F发生取代反应生成HCl,HCl+NaH=NaCl+H2↑,故有氢气生成,C正确;
D.F中的氟原子以及醛基都是吸电子基,则F的N-H键极性更大,D错误;
故选AC;
【小问7详解】
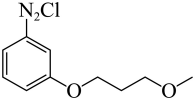
目标产物的结构简式与G类似,则其是由 和
和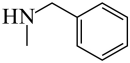 发生取代反应而合成,而
发生取代反应而合成,而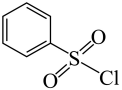 可由苯胺发生D→E的反应合成,
可由苯胺发生D→E的反应合成,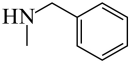 可由苯甲醛发生G→H的反应合成,故合成路线为
可由苯甲醛发生G→H的反应合成,故合成路线为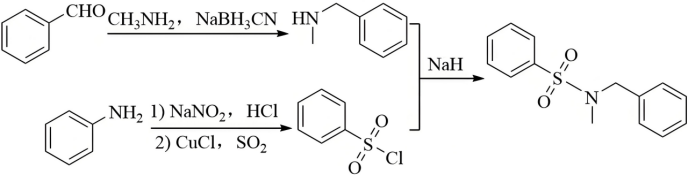 。
。

- 全部评论(0)
