离子浓度大小比较高考题型解析
时间:2016-01-07 20:44 来源: 作者:吴乾环 点击:次 所属专题: 离子浓度大小比较
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一.离子浓度大小比较的一般思路:
1、从盐类的水解的特征分析:水解程度是微弱的(一般不超过2‰)。例如:NaHCO3溶液中,c(HCO3-)>>c(H2CO3)或c(OH-)
2、理清溶液中的平衡关系并分清主次:
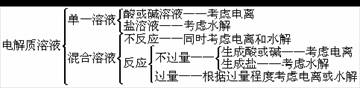
3、灵活运用三种守恒关系:电荷守恒、物料守恒及质子守恒。
①电荷守恒:如NaHCO3溶液中有:c(Na+)+c(H+)=c(HCO3-)+2 c(CO32-)+c(OH-)。
②物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。
如0.1mol/L NaHCO3溶液中 c(Na+)=0.1mol/L c(HCO3-)+c(CO32-)+c(H2CO3)= 0.1mol/L 或根据nc(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) = 0.1mol/L。(Na+):n(C)=1:1,推出:
③质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。
例如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系:c(H3O+)+c(H2CO3)=c(NH3)+c(OH-)+c(CO32-)。质子守恒也可由电荷守恒与物料守恒处理而得。
二、高考考点回顾:
离子反应是重点知识,年年必考。从近几年涉及此类问题的高考试题来看,主要有以下几种类型:
①溶质单一型
题12. (2001年全国春招题)在0.1mol·L-1 Na2CO3溶液中,下列关系正确的是( )。
A.c(Na+)=2c(CO32-
B.c(OH-)=2c(H+)
C.c(HCO3-)>c(H2CO3)
D.c(Na+)<c(CO32-)+c(HCO3-)
[解析]由于CO32-水解,故c(Na+)>2c(CO32-);又CO32-水解以第一步为主,故有c(HCO3-)>c(H2CO3),依物料守恒,有c(Na+)=2[c(CO32-)+ c(HCO3-)+ c(H2CO3)],故c(Na+)>c(CO32-)+c(HCO3-);因由水电离出H+和OH-物质的量相等,可得c(OH-)= c(H+)+ c(HCO3-)+ 2c(H2CO3),故c(OH-)≠2c(H+)。综合上述,正确答案为C。
题13. (2004年江苏卷)草酸是二元弱酸,草酸氢钾溶液呈酸性,在0.1mol/LKHC2O4溶液中,下列关系正确的是(CD)
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+ c(C2O42-)
B.c(HC2O4-)+ c(C2O42-)=0.1mol/L
C.c(C2O42-)>c(H2C2O4)
D.c(K+)= c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)
[解析]因为草酸氢钾呈酸性,所以HC2O4-电离程度大于水解程度,故c(C2O42-)>c(H2C2O4)。又依据物料平衡,所以D.c(K+)= c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)正确,又根据电荷守恒,c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),所以。综合上述,C、D正确。
②酸碱中和型
Ⅰ、恰好中和型
题14.(2003年上海高考题)在10ml 0.1mol·L-1NaOH溶液中加入同体积、同浓度Hac溶液,反应后溶液中各微粒的浓度关系错误的是( )。
A.c(Na+)>c(Ac-)>c(H+)>c(OH-)
B.c(Na+)>c(Ac-)>c(OH-)>c(H+)
C.c(Na+)=c(Ac-)+c(HAC)
D.c(Na+)+c(H+)=c(Ac-)+c(OH-)
[解析]由于混合的NaOH与HAc物质的量都为1×10-3mol,两者恰好反应生成NaAc,等同于单一溶质,故与题型①方法相同。由于少量Ac-发生水解:Ac- + H2O![]() HAc+ OH-
HAc+ OH-
故有c(Na+)>c(Ac-)>c(OH-)>c(H+),根据物料守恒C正确,根据电荷守恒D正确,A错误。故该题选项为A。
Ⅱ、pH等于7型
题15.(2002年全国高考理综)常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中( )。
A.c(HCOO-)>c(Na+)
B.c(HCOO-)<c(Na+)
C.c(HCOO-)=c(Na+)
D.无法确定c(HCOO-)与c(Na+)的关系
[解析]本题绝不能理解为恰好反应,因完全反应生成甲酸钠为强碱弱酸盐,溶液呈碱性,而现在Ph=7,故酸略为过量。根据溶液中电荷守恒:c(Na+)+ c(H+)= c(HCOO-)+c(OH-) 因pH=7,故c(H+)= c(OH-),所以有c(Na+)= c(HCOO-),答案为C。
Ⅲ、反应过量型
题16.(2005江苏卷第12题)常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是
A.pH>7,且 c(OH—) > c(Na+) > c(H+) > c(CH3COO—)
B.pH>7,且 c(Na+) + c(H+) = c(CH3COO—) + c(OH—)
C.pH<7,且c(CH3COO—) > c(H+) >c(Na+)> c(OH—)
D.pH=7,且c(CH3COO—) > c(Na+) >c(H+) = c(OH—)
题17. (2004年上海卷)将标准状况下的2.24LCO2通入150ml1mol/LnaOH溶液中,下列说法正确的是(A)
A.c(HCO3-)略大于c(CO32-)
B.c(HCO3-)等于c(CO32-)
C.c(Na+)等于c(CO32-)与c(HCO3-)之和
D.c(HCO3-)略小于c(CO32-)
[解析]因为,所以生成0.05mol Na2CO3和0.05 mol NaHCO3,而CO32-水解性大于HCO3-水解性,故A项正确。
题18.(2005全国卷III第10题)向0.1mol·L-1NaOH溶液中通入过量CO2后,溶液中存在的主要离子是( B )
A Na+、CO32-
B Na+、HCO3-
C HCO3-、CO32-
D Na+、OH-
③盐与碱(酸)反应型
题19. (2001年上海高考题)将0.1mol·L-1 醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后,溶液显酸性,则溶液中有关粒子浓度关系正确的是( )。
A.c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
B.c(CH3COO-)>c(Cl-)+c(CH3COOH)>c(H+)
C.c(CH3COO-)=c(Cl-)>c(H+)>c(CH3COOH)
D.c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-)
[解析]两溶液混合反应后,溶液实质上是生成等浓度醋酸和醋酸钠、氯化钠的混合溶液。因溶液呈酸性说明CH3COO-的水解程度小于CH3COOH的电离程度,所以c(CH3COO-)>c(Cl-)>c(CH3COOH),但CH3COOH电离程度较小,c(CH3COOH)>c(H+),故选项A、C错误,B正确。依据电荷守恒原则,可知选项D也正确。综合上述答案选B、D。
④不同物质同种离子浓度比较型:
题20. (1996年上海高考题)物质的量浓度相同的下列溶液中,NH4+浓度最大的是( )。
A.NH4Cl B.NH4HSO4 C.NH3COONH4 D.NH4HCO3
[解析] NH4+在溶液中存在下列平衡:NH4+ + H2O![]() NH3·H2O + H+ B中NH4HSO4电离出大量H+,使平衡向左移动,故B中c(NH4+)大于A中的c(NH4+),C项的CH3COO-和D项的HCO3-水解均呈碱性,使平衡向右移动,故C、D中c(NH4+)小于A中c(NH4+),正确答案为B。
NH3·H2O + H+ B中NH4HSO4电离出大量H+,使平衡向左移动,故B中c(NH4+)大于A中的c(NH4+),C项的CH3COO-和D项的HCO3-水解均呈碱性,使平衡向右移动,故C、D中c(NH4+)小于A中c(NH4+),正确答案为B。

- 全部评论(0)
