电解法制氢氧化亚铁
时间:2011-08-17 21:27 来源:未知 作者:祝其君 点击: 次 所属专题: 氢氧化亚铁
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
按照现行中学化学教材必修本第二册,实验[3-1]制备Fe(OH)2,往往得不到理想的白色絮状沉淀,对此实验曾有很多改进措施,但其操作方法繁琐或者实验条件过于苛刻而难以推广。在教学中,我们通过多次探索,采用电解法制备Fe(OH)2,方法简便,现象明显。
一、实验用品:
Na2SO4溶液、稀盐酸、蒸馏水、铁电极(两支)导线、低压电源、试管(25mm×100mm)、铁架台、三孔橡皮塞。
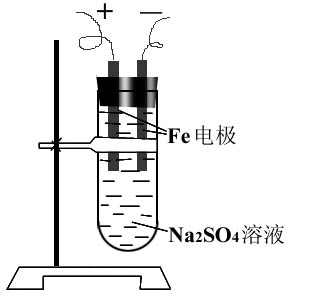
二、实验装置(如图)
三、实验原理:
用铁作电极,Na2SO4溶液作电解液,电极反应式为: 阴极:2H2O + 2e === H2↑ + 2OH-
阳极:Fe -2e === Fe2+
阴极附近产生的OH-与阳极溶解产生的Fe2+结合生成Fe(OH)2。
Fe2+ + 2OH-=== Fe(OH)2
由于阴极产生的H2是还原性气体并且阻止了空气中的氧气进入溶液,所以,可以较长时间地保留Fe(OH)2白色絮状沉淀。
四、实验步骤:
1.取Na2SO4溶液30mL,加热煮沸去除溶液中的溶解氧。
2.将两铁电极浸入稀盐酸中,除去电极表面的氧化层,然后用蒸馏水冲洗干净。
3.按如图所示装置接通直流电源,将电压调至4~6V。
五、实验现象: 通电后即看到阴极有大量气体产生,同时溶液中出现大量絮状白色沉淀。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
