判断分子空间结构的方法
时间:2022-07-29 10:13 来源:连云港新海中学 作者:祝其君 点击: 次 所属专题: 分子空间结构判断
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
分子的立体构型是指分子中的原子在空间的排布,由键长和键角共同决定。在高中阶段,判断分子的空间构型,常用的方 法有3种。
—、价层电子对互斥模型(VSEPR)
早在1940年,希吉维克和坡维尔在总结实验事实的基础上提出了一种简单的理论模型,用以预测简单分子或离子的立体 结构.这种理论模型后经吉列斯比和尼霍尔姆在20世纪50年 代加以发展,定名为价层电子对互斥模型,简称VSEPR.
价层电子对互斥模型的要点是:分子中的价电子对总是尽可能地互斥,均匀地分布在分子中。
对于ABm型分子或离子(A是中心原子,B是配位原子), 分子或离子的价电子对数可以通过下式确定:
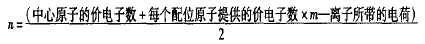
该式中,中心原子的价电子数等于中心原子的最外层电子数,配位原子中卤素原子、氢原子按提供1个价电子计算,氧原 子和硫原子按不提供价电子计算,阳离子所带的电荷代入时取 正值,阴离子所带的电荷代入时取负值。
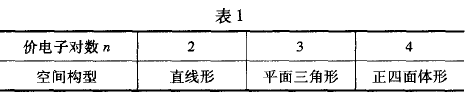
(1)若价电子对全是成键电子对的分子或离子,则该分子或离子的空间构型见表1.
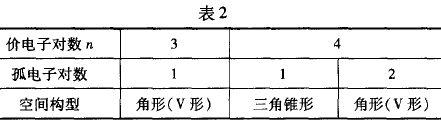
(2)若价电子对是既有成键电子对又有孤电对的分子或 离子,则该分子或离子的空间构型见表2。
例1试判断下列粒子的空间构型:①NO2 ②ClO3-
解析:①代人计算式n=2.5(四舍五入为3),又因为N上 有1个单电子(NO2中N为+4价),所以NO2分子的空间构型 为V形;②代人计算式n = (7 + l)/2 = 4,又因为Cl上有1对 孤电子对(其中Cl为+ 5价),所以ClO3-的空间构型为三角 锥形。
二、杂化轨道理论
美国化学家鲍林于1931年提出了杂化轨道理论,轨道杂化是指不同类型、能量相近的原子轨道,在形成分子的成键过程中重新组合成一系列能量相等的新的轨道。这种轨道重新组合的过程叫做杂化,所形成的新轨道称为杂化轨道。高中阶段常见的三种杂化轨道是:
(1)1个ns轨道和3个np轨道杂化,得到正四面体形分布 的4个sp3杂化轨道;
(2)1个ns轨道和2个np轨道杂化,得到平面三角形分布 的3个sp2杂化轨道;
(3)1个ns轨道和1个np轨道杂化,得到直线形分布的2 个sp杂化轨道。
形成的杂化轨道只可以用于形成σ键和容纳孤电子对,一 对孤电子对占据一个轨道。
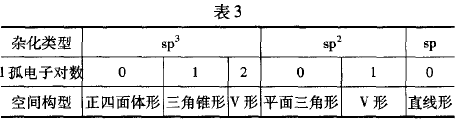
根据分子(ABm)的结构式,再判断出中心原子A上的孤电 子对数,即可预测出中心原子A的杂化类型.杂化轨道类型与 分子或离子的空间构型关系见表3。
例2:试判断HCHO分子的空间构型。
解析:根据甲醛的结构式,可判断出中心原子C上无孤电子对,需形成3个杂化轨道(π键不参与杂化),所以甲醛分子中的C原子采用sp2杂化,空间构型为平面三角形。
评注:但凡能直接画出结构式的分子,通常用杂化轨道理论 来判断该分子的空间构型。
三、等电子体原理
人们研究分子结构时,根据许多类似的实验事实,总结出一 条经验规律:具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,这一原理称为“等电子体原理”。这里的“结 构特征”既包括分子的立体构型,又包括化学键的类型,但键角 并不一定相等.
利用等电子体原理可以判断一些简单分子或离子的立体 构型.常见的等电子体(见表4).
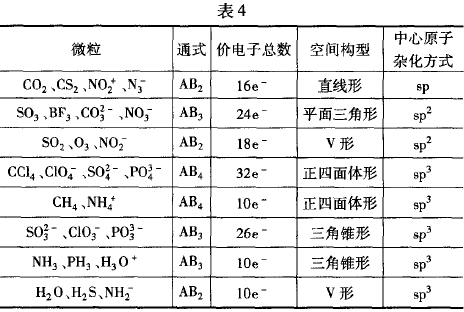
例3试根据等电子体原理,判断N2O的空间构型
解析:N2O与CO2互为等电子体,CO2是直线形分子,所以 N2O的空间构型是直线形。

- 全部评论(0)
(2476627093) 评论 href="/plus/view.php?aid=15824">判断分子空间构型的:非常有帮助,条理清晰
(125825355) 评论 href="/plus/view.php?aid=15824">判断分子空间构型的:匿名评论就要丢掉素质吗?
(2976162134) 评论 href="/plus/view.php?aid=15824">判断分子空间构型的:你母亲死了
(2644737968) 评论 href="/plus/view.php?aid=15824">判断分子空间构型的:挺好的,我看懂
(2697007340) 评论 href="/plus/view.php?aid=15824">判断分子空间构型的:满意,你真棒
(3517435087) 评论 href="/plus/view.php?aid=15824">判断分子空间构型的:编编真的很棒,一看便懂了,爱你,还短啊,那就再爱你一下,
(3517435087) 评论 href="/plus/view.php?aid=15824">判断分子空间构型的:编编真的很棒,一看便懂了,爱你,还短啊,那就再爱你一下,
(1923148194) 评论 href="/plus/view.php?aid=15824">判断分子空间构型的:好棒啊,对我很有用,想起了之前忘掉的知识!
