σ键、π键和大π键
时间:2022-08-07 07:54 来源:未知 作者:李留记 点击: 次 所属专题: 大π键 π键 σ键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
当原子之间只有一对电子时,这对电子形成的化学键为单键。单键是σ键,σ键是成键的两个原子的轨道沿着两核连线方向“头碰头”进行重叠而形成的共价键。s与s轨道,s与p轨道,p与p轨道以及s、p与杂化轨道,杂化轨道和杂化轨道之间都可以形成σ键。σ键的特点是重叠的电子一在两核连线上,受原子核束缚力较大,重叠程度也大,比较牢固,σ键绕轴旋转时,电子云重叠程度不受影响。电子云对两个原子核的连线——键轴呈圆柱形对称。
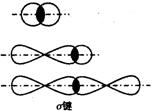
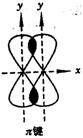
当原子之间有一对以上电子时,所对应的化学键称为重键。最常见的重键是由一个σ键和一个或数个p—pπ键或p—p大π键组成的。π键是成健原子的p轨道电子云“肩并肩”进行重叠而形成的共价键。一般来说,π健不能独立存在,总是和σ键一起形成双键或叁键。π键的特点是重叠的电子云分布在两核连线的两方,受原子核束缚力小,电子云重叠程度要比σ键小得多,所以π键不如σ键牢固。但是π键电子云受原子束缚力小,电子的能量较高,易活动,其化学性质较σ键活泼。π键绕键轴(两轴连线)旋转后会发生破裂。
形成p—pπ键和p—p大π键的条件是分子或离子里有平行的p道可以容纳分子中的电子(一般在电子占据能量较低的σ和孤对电子对的轨道后)。p—p大π键是存在于两个以上原子核之间的化学键,常称为“离域大π键”。大π键的符号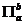 。其中的a是平行p轨道数,b是这些轨道里的电子数。当a=b=2时,就是一般的p—pπ键。应当注意,b<2a,否则不能形成π键。
。其中的a是平行p轨道数,b是这些轨道里的电子数。当a=b=2时,就是一般的p—pπ键。应当注意,b<2a,否则不能形成π键。
1.甲醛分子中的p—pπ键
甲醛分子中心原碳采取sp3杂化轨道,碳原子上还有一个未参加杂化的p轨道是与分子的σ键形成的骨架平面垂直的,氧原子上有一个p轨道与碳原子的上p产轨道互相平行,形成一个p—pπ键。在π键里的电子数可以通过下面的顺序来计算:
①甲醛分子里的电子总数==中性原子的价电子之和==2×1+4+6==12。
②计算σ键和孤对电子的电子数:2H—C+C—O+4==10。
③剩下的电子是在p—pπ键或p—p大π键里的电子:12-10==2。
所以甲醛分子里的p—pπ键是一般的p—pπ键。
2.苯分子里的p—p大π键
苯分子里的每个碳原子取sp2杂化轨道,每个碳原子有一未参加杂化的p轨道。由于苯分子是平面分子,因此6个未参加杂化的p轨道是互相平行的。其中的电子数的计算如下:6×1(H)+6×4(C)==30;30-6×2-6×2==6。所以苯分子里有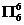 型p—p大π键。
型p—p大π键。
3.CO2分子里的大π键。
CO2是直线形的分子,在中心原子碳原子上没有抓对电子。根据杂化轨道理论,CO2分子的碳原于取sp杂化轨道。应当特别强调指出的是:当某原子采取sp杂化轨道时,它的两个未参加杂化的p轨道在空间的取向是踉sp杂化轨道的轴呈正交的关系(即相互垂直)。对于CO2分子,有两套O—C—O相互平行的由三个原子提供的3个p—轨道。 CO2分子共有4+2×6==16个价电子,两个C—Oσ键和每个氧原子上的一对孤对电子对总共8个电子,尚余8个电子应当填入上述两套三原子的平行产轨道,即每套是三个轨道4个电子,标为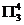 。换言之,CO2分子里有两套
。换言之,CO2分子里有两套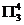 p—p大π键。
p—p大π键。
4.O3分子里的大π键
臭氧分子是平面三角形(包括氧原子上的孤对电子对)的理想模型(O原子的成的σ键骨架呈角型)。根据杂化轨道理论,臭氧分子中的中心氧原子取sp2杂化轨道。应当特别强调指出的是,所有的取sp2杂化轨道的原子都尚有一个未参与杂化的p轨道,它在空间的取向是垂直于分子平面。对于臭氧分子,每个配位氧原子有一对孤对电子对取原来的s轨道,有一对孤对电子对取原来的p轨道而且不同氧原子上的这个孤对电子互不平行,于是还有一套三原子的相互平行的三个p轨道。在这套平行的p轨道里应当容纳3×6-2×2-2×4==4个电子,因此分子里有一套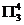 大π键。
大π键。

- 全部评论(0)
(2121340356) 评论 href="/plus/view.php?aid=10847">σ键、π键和大π键:感谢您很详细
