酸碱盐知识归纳
时间:2016-01-17 15:01 来源:未知 作者:孙法军 点击: 次 所属专题: 物质分类 酸碱盐
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
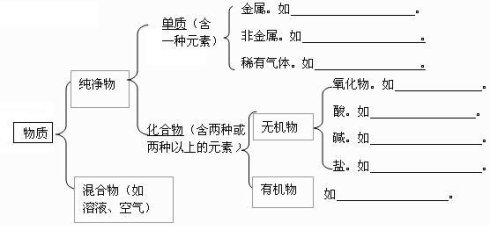
一、酸、碱、盐的概念
物质 | 酸 | 碱 | 盐 |
概念 | 电离时解离出的阳离子全部是氢离子的化合物 | 电离时解离出的阴离子全部是氢氧根离子的化合物 | 由金属阳离子(或NH4+)和酸根阴离子组成的化合物 |
形式 | 酸 = H++ 酸根阴离子 | 碱 = 金属阳离子+OH- | 盐=金属阳离子+酸根阴离子 |
举例 | HCl、 H2SO4 HNO3、H2CO3 CH3COOH | NaOH 、KOH Mg(OH)2 Ca(OH)2 | NaC l KNO3 NH4Cl NaHCO3 Cu2(OH)2CO3 |
备注 | 溶液呈酸性,PH < 7 | 溶液呈碱性,PH > 7 | 多数盐溶液呈中性,PH=7 |
①他们的溶液都不显电性 | |||
二、常见的酸
1、浓硫酸的特性
特性 | 吸水性, | 脱水性 (腐蚀性) | 氧化性 | 浓硫酸的稀释:----放热 |
实质 | 吸去混合气体中的水份 | 将有机物中的氢、氧元素按原子2:1的个数比夺掉 | 浓硫酸与活泼的和某些不活泼的金属都能作用,但不能生成氢气,而是水 | 溶解时扩散所吸收的热小于水合放出的热 |
用途: | 可作干燥剂(可干燥H2、O2、CO2等) | | 能使铁钝化,可用铁制品盛装浓硫酸 | |
注意: | 不能干燥碱性气体如NH3 | 浓硫酸对皮肤和衣物有很强的腐蚀性,使用时一定要小心。 | 不能用浓硫酸制氢气 | 稀释时:必须是酸入水、慢慢、搅拌 |
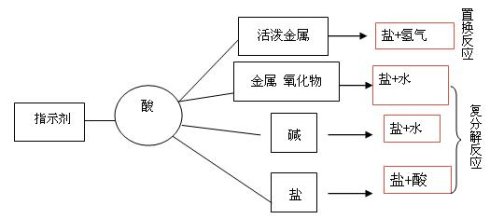
2、常见的酸──盐酸和稀硫酸
酸 | 盐酸(HCl) | 硫酸(H2SO4) | 备注及用途 | |
物理性质 | 无色液体,易挥发,有刺激性气味,在空气中形成白雾(盐酸越浓越易挥发) | 无色液体,无挥发性,无气味 | 浓度越大,其密度就越大 | |
化学性质 | 1.跟指示剂的反应 | (PH < 7、溶液呈酸性) 使紫色石蕊试液变红 遇无色酚酞试液不变色 | 利用这性质可以①鉴别某物质是否是酸性 | |
2.跟金属反应 | 2HCl+Zn=ZnCl2+H2↑ | H2SO4+Zn=ZnSO4+H2↑ | 利用这性质可以①制盐和氢气; ②可以判断金属的活泼性 | |
2HCl+Mg=MgCl2+H2↑ | H2SO4+Mg=MgSO4+H2↑ | |||
2HCl+Fe=FeCl2浅绿+H2↑ | H2SO4+Fe=FeSO4+H2↑ | |||
酸 + 活泼金属 →盐 + | ||||
3.跟金属氧化物的反应 | Fe2O3+6HCl = 2FeCl3+ 3H2O | Fe2O3+ 3H2SO4= Fe2(SO4)3+ 3H2O | 可用于: ① ② | |
2HCl + CuO | H2SO4+ CuO =Cu SO4+ H2O | |||
酸 + 金属氧化物 → 盐 + 水 | ||||
4.跟碱反应 | HCl + NaOH = NaCl + H2O | H2SO4+2NaOH = | 利用这性质可以①制盐; ②中和胃酸用---Al(OH)3;③除去水垢中的Mg(OH)2 | |
2HCl+Cu(OH)2=CuCl2+2H2O | H2SO4+ Cu(OH)2 = CuSO4+ 2H2O | |||
酸 + 碱 → 盐 + 水 | ||||
5、跟某些盐的反应 | 2HCl+Na2CO3= 2NaCl+H2O+CO2↑ | H2SO4+ Na2CO3= Na2SO4+H2O+ CO2↑ | 利用这性质可以①区别盐酸和硫酸-----用BaCl2;溶液;②用盐酸制CO2气体; ③制盐;④除去水垢中的CaCO3。 | |
2HCl+CaCO3= CaCl2+H2O+CO2↑ | H2SO4+CaCO3= Ca SO4+H2O+ CO2↑ | |||
HCl + AgNO3= AgCl↓+ HNO3 | H2SO4+ BaCl2= BaSO4↓+2HCl | |||
酸 + 盐 → 盐 + 酸 | ||||
酸的共性:(原因是酸溶液中的阳离子全是H+)
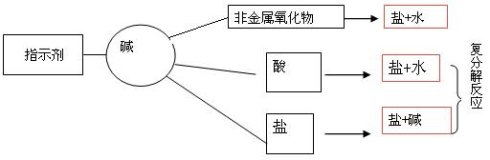
三、常见的碱──NaOH 和Ca(OH)2
碱 | 氢氧化钠(NaOH) | 氢氧化钙Ca(OH)2 | 备注及用途 | |
俗名 | 苛性钠、火碱、烧碱 | CaO+H2O=Ca(OH)2 (放热反应) 熟石灰或消石灰 | CaO可作干燥剂。注意;不能干燥酸性气体 | |
物理性质 | 白色固体,易潮解(常作干燥剂),极易溶于水,溶解时放热,水溶液有很强的腐蚀性 | 白色粉末状固体,微溶于水,它的水溶液俗称石灰水,有腐蚀作用 | NaOH可作干燥剂 注意;不能干燥酸性气体( CO2、SO2、HCl等 ) | |
化学性质 | 与指示剂反应 | (PH>7, 溶液呈碱性) 其溶液能使石蕊试液变蓝、酚酞试液变红 | 利用这性质可以鉴别某物质是否是碱性 | |
与非金属氧化物反应 | 2NaOH +CO2=Na2CO3+H2O 2NaOH +SO2=Na2SO3+H2O 2NaOH +SO3=Na2SO4+H2O | Ca(OH)2+CO2=CaCO3↓+H2O | ①鉴别Ca(OH)2和NaOH──可用CO2 ②NaOH和 Ca(OH)2-的保──隔绝空气 ③Ca(OH)2──可用建筑业上 | |
碱 + 非金属氧化物 → 盐 + 水 (该类反应不是复分解反应—--没相互交换成分) | ||||
与酸反应(中和反应) | NaOH + HCl = NaCl + H2O 2NaOH+H2SO4= Na2SO4+2H2O | Ca(OH)2+2HCl= Ca(OH)2+H2SO4= CaSO4+2H2O | 利用这个性质: ①农业上中和酸性土 ②被氢氧化钠烧伤的皮肤可用硼酸处理 | |
酸 + 碱 → 盐 + 水 | ||||
与某些盐的反应 | CuSO4+2NaOH= Cu(OH)2↓+Na2SO4 | Ca(OH)2+CuSO4= Cu(OH)2↓+Ca SO4 | ①配制农药波尔多液 利用这个性质: ①可制造NaOH(即纯碱制烧碱) ②鉴别Ca(OH)2和NaOH | |
FeCl3+ 3NaOH = Fe(OH)3↓+3NaCl | Ca(OH)2溶液也能与FeCl3溶液反应 | |||
NaOH +Na2CO3(不反应) | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | |||
碱的共性:(原因是碱溶液中的阴离子全是OH-)
四、盐的性质:(盐无共同的离子,故无共同的性质。但总的体现为下列的性质)
物理 性质 | ①常温下一般为固体,溶解性各不相同; ②盐的水溶液多为无色;而Cu2+的盐溶液蓝色;Fe2+的盐溶液浅绿色、 |
| 水溶液的酸碱性各不同 |
化 学 性 质 | ①盐 + 活泼的金属 → 盐 + 不活泼金属 |
②盐 + 酸 → 新盐 + 新酸 | |
③盐 +(可溶的)碱 → 新盐 + 新碱; | |
④盐 + 某些盐 → 新的两种盐 | |
盐的鉴别 | 碳酸盐(CO32-)的鉴别──用盐酸和石灰水 如:K2CO3+ 2HCl = 2KCl + H2O + CO2↑ |
硫酸盐(SO42-)的鉴别──用氯化钡溶液和稀硝酸 如:K2SO4+ BaCl2= Ba SO4↓+ 2KCl | |
盐酸盐(Cl-)的鉴别──用硝酸银溶液和稀硝酸 如:AgNO3+ NaCl = AgCl↓+ Na NO3(氯化银不与稀硝酸反应即不溶于稀硝酸) | |
铵盐(NH4+)的鉴别──用氢氧化钠溶液或与熟石灰研磨 如: NH4Cl + NaOH = NaCl + H2O + NH3↑ 又如:2NH4Cl + Ca(OH)2= CaCl 2+ 2H2O + 2NH3↑ |

- 全部评论(0)
