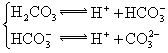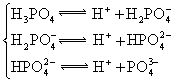高考的新宠“三大平衡常数”
时间:2020-12-16 16:05 来源:未知 作者:董啸 点击: 次 所属专题: 平衡常数
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学平衡常数、电离平衡常数、沉淀溶解平衡常数位于选修四《化学反应原理》部分,属于新课标的新增内容。从近几年的高考中发现,化学平衡常数早已成为了高考命题的热点内容;电离平衡常数和沉淀溶解平衡常数也渐有“升温”的表现,因此,可以预测这“三大平衡常数”在今后的高考中,将继续成为今后高考的重点及热点。下面将分类追踪透析。
一、化学平衡常数
典例1、(2008年宁夏卷)将固体NH4I置于密闭容器中,在一定温度下发生下列反应:![]()
![]() ,达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为( )
,达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为( )
A.9 B.16 C.20 D.25
解析:由平衡时氢气的浓度可求得反应②分解消耗HI的浓度,c(HI)= 0.5mol·L-1×2=1mol/L,故①式生成c(HI)= c(HI)平衡+ c(HI)分解= 4mol·L-1+1mol/L =5mol·L-1,c(NH3)平衡= c(HI)①= 5mol·L-1,根据化学平衡常数公式K= c(NH3)平衡×c(HI)平衡=5 mol/L×4mol·L-1,故答案选C。
点评:本题考查的是应用化学平衡常数公式求算化学平衡常数。学生易错选D,原因是将①式生成的c(HI)= 5 mol/L代入了公式中进行了求算,而未带入平衡时HI的浓度(4mol·L-1)。因此,在求算化学平衡常数时,一定要严格的按照化学平衡常数的含义进行。
方法规律:
①对于一般的可逆反应:mA(g)+ nB(g)![]() pC(g)+qD(g),其中m、n、p、q分别表示化学方程式中个反应物和生成物的化学计量数。当在一定温度下达到化学平衡时,这个反应的平衡常数公式可以表示为:
pC(g)+qD(g),其中m、n、p、q分别表示化学方程式中个反应物和生成物的化学计量数。当在一定温度下达到化学平衡时,这个反应的平衡常数公式可以表示为:![]() ,各物质的浓度一定是平衡时的浓度,而不是其他时刻的.
,各物质的浓度一定是平衡时的浓度,而不是其他时刻的.
②在进行K值的计算时,固体和纯液体的浓度可视为“1”。例如:Fe3O4(s)+4H2(g)![]() 3Fe(s)+4H2O(g),在一定温度下,化学平衡常数
3Fe(s)+4H2O(g),在一定温度下,化学平衡常数
![]() 。
。
③利用K值可判断某状态是否处于平衡状态。例如,在某温度下,可逆反应mA(g)+nB(g)![]() pC(g)+qD(g),平衡常数为K。若某时刻时,反应物和生成物的浓度关系如下:
pC(g)+qD(g),平衡常数为K。若某时刻时,反应物和生成物的浓度关系如下:
![]() ,则有以下结论:
,则有以下结论:
K'=K ,V(正)=V(逆),可逆反应处于化学平衡状态;
K'<K ,V(正)>V(逆),可逆反应向正反应方向进行;
K'>K ,V(正)<V(逆),可逆反应向逆反应方向进行。
④化学平衡常数是指某一具体化学反应的平衡常数,当化学反应方程式的计量数增倍或减倍时,化学平衡常数也相应的发生变化。
针对性训练:
1.高炉炼铁中发生的基本反应如下:FeO(s)+CO(g) ![]() Fe(s)+CO2(g)(正反应为吸热反应),已知1100℃时,该反应的化学平衡常数为0.263。若在1100℃时,测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下该反应是否处于平衡状态_______(填“是”或“否”),此时化学反应速率是V正____V逆(填“大于”、“小于”或“等于”),其原因是 。
Fe(s)+CO2(g)(正反应为吸热反应),已知1100℃时,该反应的化学平衡常数为0.263。若在1100℃时,测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下该反应是否处于平衡状态_______(填“是”或“否”),此时化学反应速率是V正____V逆(填“大于”、“小于”或“等于”),其原因是 。
答:由于此时K/=c(CO2)/c(CO)= (0.025 mol·L-1) / (0.1 mol·L-1)=0.25≠K =0.263,所以反应不处于平衡状态,又因为0.25<0.263,则v正 > v逆,化学平衡向正反应方向移动。
典例2.二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g)![]() 2SO3(g)。某温度下,SO2的平衡转化率(a )与体系总压强(p)的关系如图所示。
2SO3(g)。某温度下,SO2的平衡转化率(a )与体系总压强(p)的关系如图所示。
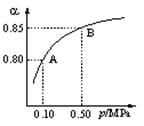
根据图示回答下列问题:(1)平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
解析:平衡状态由A变到B时,增大了压强(由0.10 MPa→0.50 MPa),故SO2的平衡转化率(a )变大;由于平衡常数K不受压强、浓度的影响,只受温度的影响,而体系的的温度不变,所以平衡常数K值不变。
点评:(1)化学平衡常数的大小只与温度有关,不随反应物或生成物浓度的改变而改变。本题已指明是“在某温度下,SO2的平衡转化率(a )与体系总压强(p)的关系”,说明温度不变,改变的只有物质的浓度,故化学平衡常数不变。学生易错的主要原因是不能结合题目信息解读图象所致,观察分析图象的能力欠缺。
方法规律:化学平衡常数是描述可逆反应进行程度的重要参数,只与温度有关,与反应物、生成物的浓度无关,当然也不会随压强的变化而变化,即与压强无关。
2.现代炼锌的方法可分为火法和湿法两大类。火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
焙烧炉中:2ZnS+3O2=2ZnO+2SO2 ①
鼓风炉中:2C+O2=2CO ②
鼓风炉中:ZnO(s)+CO(g) ![]() Zn(g)+CO2(g) ③
Zn(g)+CO2(g) ③
⑴请写出反应③的平衡常数表达式 ,若在其它条件不变时,在鼓风炉中增大CO的浓度,平衡将向 移动,此时平衡常数 填“增大”、“减小”或“不变”)。
答:⑴根据化学方程式和平衡常数的表达式进行书写:K=c(Zn).c(CO2)/c(CO) ,增大反应物CO的浓度,虽然化学平衡向正反应移动,但平衡常数不变。
二、电离平衡常数
典例3(2008山东卷)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
解析:根据电离平衡常数公式可知:K1=c(H+)c(HCO3-)/c(H2CO3)=10-5.60×10-5.60/l.5×10-5=4.2×10-7mol. L-1。
点评:此题可直接运用电离平衡常数的公式进行计算,只要准确的代入数值计算,不难得出答案。本题易错的主要原因是对电离平衡常数的遗忘和计算不准确造成的。
典例4 下列有关电离平衡常数(K)的说法正确的是( )
A.相同条件下,电离平衡常数越小,表示弱电解质的电离能力越弱
B.电离平衡常数与温度无关
C.在CH3COOH的稀溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,当再加入量冰醋酸时,(K)值增大
CH3COO-+H+,当再加入量冰醋酸时,(K)值增大
D.多元弱酸各步电离平衡常数相互关系为K1<K2<K3
解析:K表征的是弱电解质的电离能力,它越大,表示弱电解质越易电离,反之,就越难,故A正确;电离平衡常数与化学平衡一样,只随温度的变化而变化,故B、C错误;多元弱酸各步电离平衡常数的相互关系应为K1>K2>K3
点评:电离平衡常数是表示弱电解质相对强弱的一个物理量,可根据电离平衡常数的大小,判断弱电解质的相对强弱,K值越大,即表示该电解质的能力越强。另外,很多学生搞不清影响电离平衡常数的因素是温度而不是浓度,而错选了C。
方法规律:
①在一定温度下,弱电解质达到电离平衡时,各种离子浓度之积与溶液中未电离的分子浓度之比是一个常数,该常数就叫电离平衡常数。如CH3COOH![]() CH3COO-+H+,K=c(CH3COO-)c(H+)/c(CH3COOH).
CH3COO-+H+,K=c(CH3COO-)c(H+)/c(CH3COOH).
②电离平衡常数是描述弱电解质的电离平衡的主要参数,也是弱酸、弱碱是否达到平衡状态的标尺。它只受温度的影响,因电离过程是吸热过程,故它随温度的升高而增大。
③对于多元弱酸来说,由于上一级电离产生的H+对下一级电离起到抑制作用,一般是K1≥K2≥K3,即第二步电离通常比第一步电离难得多,第三步电离又比第二步电离难得多,因此在计算多元素弱酸溶液的c(H+)或比较弱酸酸性相对强弱时,通常只考虑第一步电离。
针对性训练:
1.对于弱酸,若25℃时,有![]()
![]()
![]() ,在一定温度下达到电离平衡,K为电离平衡常数,下表是几种常见弱酸的电离平衡常数(25℃)
,在一定温度下达到电离平衡,K为电离平衡常数,下表是几种常见弱酸的电离平衡常数(25℃)
酸 | 电离方程式 | 电离平衡常数K |
|
|
|
|
|
|
|
|
|
|
|
|
回答下列各问:
(1)若在该温度下,继续不断加入少量的冰醋酸,K值________(填“增大”、“减小”、“不变”).
(2)在温度相同时,各弱酸的K值不同,则K值的大小与酸性的相对强弱的关系是______________________________________.
(3)若把![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 都看作是酸,其中酸性最强的是_________,最弱的是________.
都看作是酸,其中酸性最强的是_________,最弱的是________.
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数.对于同一种多元弱酸的![]() 、
、![]() 、
、![]() 之间存在着数量上的规律,此规律是________________,产生此规律的原因是__________.
之间存在着数量上的规律,此规律是________________,产生此规律的原因是__________.
(5)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,C mol/L的![]() 的电离程度为a .试表示该温度下醋酸的电离平衡常数
的电离程度为a .试表示该温度下醋酸的电离平衡常数![]() _________。
_________。
答案:(1)不变(2)K值越大,酸性越强(3)![]()
![]() (4)
(4)![]() ,上一级电离产生的
,上一级电离产生的![]() 对下一级电离过程有抑制作用
对下一级电离过程有抑制作用
(5)![]()
三、沉淀溶解平衡常数
典例5 (2008年山东卷)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
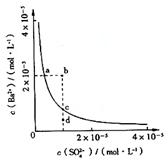
提示:BaSO4(s) ![]() Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
解析:当加入Na2SO4溶液时,c(SO42-)增大,沉淀溶解平衡向沉淀析出方向进行,则c(Ba2+)会减小,故A错;蒸发溶液时,可使溶液的c(SO42-)和c(Ba2+)同时增大,而d→c显示c(SO42-)未变,故B错;d状态点,因其在沉淀溶解平衡点c点的下方,说明未达到沉淀溶解平衡状态,故无BaSO4沉淀生成,C正确;D项,因a、c两点对应的都是在相同的温度下的Ksp,故二者的Ksp相同,D错。本题答案选C。
点评:本题主要考查了沉淀的溶解和生成过程中离子浓度的变化、影响Ksp的因素及沉淀析出的条件等,解题主要策略是应用化学平衡移动理论。学生易错的原因主要在于对于沉淀溶解平衡的理论掌握不到位,同时也不能正确的结合图象进行分析,从而不知所措而错选。
典例6 (2008年广东卷)已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034mol·L-1)。若t1时刻在上述体系中加入100mL0.020mol·L-1Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是( )
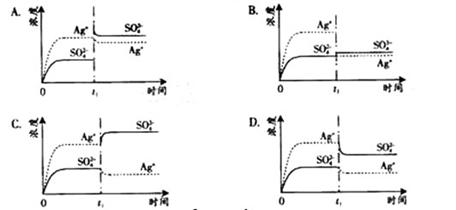
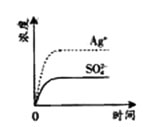
解析:因Ag2SO4溶液中存在沉淀溶解平衡Ag2SO4 ![]() 2Ag+ + SO42- ,在Ag2SO4饱和溶液中,因为c(Ag+)=0.034mol/L,所以c(SO42-)=c(Ag+)/2=0.017mol/L;当加入100ml 0.020mol/LNa2SO4溶液后,溶液中c(SO42-)=0.1L×0.017mol/L+0.1L×0.02mol/L=0.0185mol/L,c(Ag+)=0.034mol/L×0.1L/0.2L=0.017mol/L,此时Qc=c(Ag+)×c(SO42-)<Ksp,溶液处于未饱和状态。故答案选B。
2Ag+ + SO42- ,在Ag2SO4饱和溶液中,因为c(Ag+)=0.034mol/L,所以c(SO42-)=c(Ag+)/2=0.017mol/L;当加入100ml 0.020mol/LNa2SO4溶液后,溶液中c(SO42-)=0.1L×0.017mol/L+0.1L×0.02mol/L=0.0185mol/L,c(Ag+)=0.034mol/L×0.1L/0.2L=0.017mol/L,此时Qc=c(Ag+)×c(SO42-)<Ksp,溶液处于未饱和状态。故答案选B。
点评:(1)本题主要考查改变饱和溶液中离子浓度时沉淀溶解平衡移动的情况,正确的求算各离子浓度的大小以及结合图象进行分析,显得相当重要,要求学生具备对图象数据的观察能力与分析能力。
方法规律:
①公式:对于沉淀溶解平衡:MmNn(s)![]() mMn+(aq)+nNm-(aq)。固体纯物质不列入平衡常数。上述反应的平衡常数为:Ksp=[c(Mn+)]m[c(Nm-)]n,符号为Ksp
mMn+(aq)+nNm-(aq)。固体纯物质不列入平衡常数。上述反应的平衡常数为:Ksp=[c(Mn+)]m[c(Nm-)]n,符号为Ksp
②影响因素:在一定的温度下,它是一个常数,称为溶度积常数,简称溶度积,它只受温度影响,不受溶液中物质浓度的影响。
③溶度积的应用:通过比较溶度积和溶液中有关离子浓度幂的乘积(离子积Qc)的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解。
Qc>Ksp溶液过饱和,有沉淀析出,直至溶液饱和达到新的平衡状态
Qc= Ksp溶液饱和,沉淀与溶解处于平衡状态
Qc<Ksp溶液未饱和,无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和。
针对性训练:
1.已知25℃时,电离常数Ka(HF)=3.6×10-4mol·L-1,溶度积常数Ksp(CaF2)=1.46×10-10mol3·L-3。现向1L 0.2 mol·L-1HF溶液中加入1L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是( )
A.25℃时,0.1 mol·L-1HF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中Ksp(CaF2)= ![]()
D.该体系中有CaF2沉淀产生
2.某温度时,AgCl (s)![]() Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
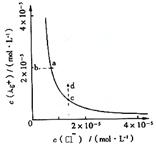
提示:AgCl (s) ![]() Ag+(aq)+Cl-(aq)的平衡常数Ksp=c(Ag+)·c(Cl-),称为溶度积常数。
Ag+(aq)+Cl-(aq)的平衡常数Ksp=c(Ag+)·c(Cl-),称为溶度积常数。
A.加入AgNO3可以使溶液由c点变到d点
B.通过稀释可以使溶液由d点变到c点
C.d点有AgCl沉淀生成
D.b点对应的Ksp小于a点对应的Ksp
答案:1、D 2、C

- 全部评论(0)