中学化学中氢氧化钠的作用
时间:2023-03-02 10:37 来源:未知 作者:张楠 点击: 次 所属专题: 氢氧化钠
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氢氧化钠是学生从初中开始学习化学时就接触到的强碱性物质,它在整个高中学习中有着极其重要的作用,广泛用于各种生产生活过程和化学解题过程中。如果能熟练地运用氢氧化钠的性质,将整个高中的知识贯穿起来,使其成为联系各类物质的纽带,那么,以氢氧化钠为主体的完整的知识体系就会显得更加系统简洁,对高中化学知识的理解就会更深刻,应用就会更自如。
CO2少量:CO2+2NaOH == Na2CO3,
CO2过量:CO2+NaOH == NaHCO3
SO2少量:SO2+2NaOH == Na2SO3+H2O,
SO2过量:SO2+NaOH == NaHSO3
SO3+2NaOH == Na2SO4+H2O,
P2O5+6 NaOH == 2Na3PO4+3H2O
SiO2+2NaOH ==Na2SiO3+H2O
H2SO4+2NaOH ==Na2SO4+2H2O
HClO+ NaOH==NaClO+H2O
H2SO3+2NaOH ==Na2SO3+2H2O,
H2SO3+NaOH ==NaHSO3+H2O
H2S + 2NaOH == Na2S+ 2H2O,
H2S + NaOH == NaHS+ H2O
H2SiO3+2NaOH ==Na2SiO3+2H2O
NH4++ OH- NH3↑+H2O (NH4+的特性检验反应)
NH3↑+H2O (NH4+的特性检验反应)
Mg2++2OH-==Mg(OH)2↓(白色沉淀不溶于过量NaOH)
Al3++3OH-==Al(OH)3↓(白色沉淀可溶于过量NaOH)
Zn2++2OH-==Zn(OH)2↓(白色沉淀可溶于过量NaOH)
Fe2++2OH-==Fe(OH)2↓(白色沉淀不溶于过量NaOH,放置后转为灰绿色,最后转为红褐色)
Fe3++3OH-==Fe(OH)3↓(红褐色沉淀不溶于过量NaOH)
Cu2++2OH-==Cu(OH)2↓(蓝色沉淀不溶于过量NaOH)
Ag++OH-== AgOH↓(白色沉淀不溶于过量NaOH,沉淀易转为暗褐色)
NaHSO4+NaOH==Na2SO4+H2O(H++OH-== H2O)
NaHCO3+NaOH == Na2CO3+H2O (HCO3-+OH-==CO32-+H2O)
NaHS +NaOH == Na2S+H2O (HS-+OH-==S2-+H2O)
NaH2PO4+2NaOH ==Na3PO4+2H2O(H2PO4-+2OH-==PO43-+2H2O)
NaOH过量:Ca(HCO3)2+2NaOH == Na2CO3+2H2O+CaCO3↓
Ca2++2HCO3-+2OH-== CO32-+2H2O+CaCO3↓
NaOH不足量:Ca(HCO3)2+NaOH == NaHCO3+H2O+CaCO3↓
Ca2++HCO3-+OH-== H2O+CaCO3↓
Mg(HCO3)2+4NaOH == Na2CO3+2H2O+ Mg(OH)2↓
NH4HSO3+2NaOH Na2SO3+2H2O+NH3↑
Na2SO3+2H2O+NH3↑
Al2O3+2OH-+3H2O ===2[Al(OH)4]-,Al(OH)3+OH-=== [Al(OH)4]-
ZnO+2OH-+H2O ===[Zn(OH)4]2-,Zn(OH)2+2OH-=== [Zn(OH)4]2-
2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑,
Si+2OH-+H2O===SiO32-+2H2↑
Cl2等卤素单质(吸收余氯、除去溴苯中的溴单质)
Cl2+2NaOH==NaClO+NaCl+H2O,
Br2+2NaOH==NaBrO+NaBr+H2O
S单质(洗涤粘在试管中的硫单质)
3S+6NaOH(热)==Na2SO3+2Na2S+3H2O
2NO2+2NaOH==NaNO3+NaNO2+H2O
NO+NO2+2NaOH== 2NaNO2+H2O
如:亚硫酸钠碱性溶液中滴加碘水,碘水褪色:
SO32-+I2+2OH-===SO42-+2I-+H2O
向盐卤中加入NaClO和少量NaOH的方法可将Fe2+、Fe3+等除去:
2Fe2++ ClO-+4OH-+H2O===Cl-+2Fe(OH)3↓,
Fe3++3OH-==Fe(OH)3↓
CH3COONa + NaOH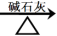 CH4↑+ Na2CO3
CH4↑+ Na2CO3
2.氯代烃水解:
CH3CH2Br + H2O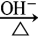 CH3CH2OH + HBr
CH3CH2OH + HBr
或(CH3)2CHCH2CH2Br +NaOH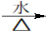 (CH3)2CHCH2CH2OH + NaBr
(CH3)2CHCH2CH2OH + NaBr
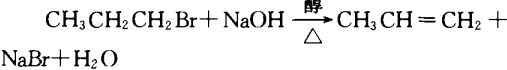
C6H5OH+NaOH C6H5ONa+H2O
C6H5ONa+H2O
CH3COOH+NaOH CH3COONa+H2O
CH3COONa+H2O
H2NCH2COOH+NaOH NH2NCH2COONa+H2O
NH2NCH2COONa+H2O
CH3COOC2H5+NaOH CH3COONa+C2H5OH
CH3COONa+C2H5OH
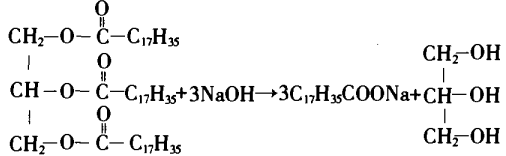
负极:CH4+10OH-=CO32-+7H2O+8e-;
正极:2O2+4H2O+8e-=8OH-;
电池总反应式为:CH4+2O2+2NaOH=Na2CO3+3H2O
将浓氨水滴加到氢氧化钠固体上,其反应原理为:一是NAOH溶解放出大量的热,促进了氨水的分解,二是提供的大量的OH-,使平衡朝着生成NH3的方向移动。平衡方程式为NH4++OH- NH3·H2O
NH3·H2O NH3+H2O。
NH3+H2O。
固体NaOH或含有NaOH的碱石灰可以用来干燥显碱性或中性的气体,如NH3、H2、O2、CH4等气体。
对于有毒、有害的气体尾气必须用适当的溶液加以吸收(或点燃),使它们变为无毒、无害、无污染的物质。如尾气Cl2、HCl、SO2、H2S、NO2、Br2(蒸气)等可用NaOH溶液吸收。
它是由氢氧化钠溶液和硫酸铜溶液,还有酒石酸钾钠配制而成的。即向NaOH溶液中滴入CuSO4溶液形成新制的Cu(OH)2悬浊液。

- 全部评论(0)
