氢氧化钠在中学化学中的应用
时间:2023-03-02 10:41 来源:未知 作者:化学自习室 点击: 次 所属专题: 氢氧化钠
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、 溶解物质
1.溶解某些金属及其氧化物,如Al、Zn、A12O3、 ZnO 等.
2A1+2NaOH+2H2O= 2NaAlO2+3 H2↑
Al2O3+2NaOH=2NaAlO2 + H2O
ZnO+2NaOH= Na2ZnO2+H2O
2.溶解某些非金属及其氧化物,如Si,SiO2等.
Si+2NaOH+H2O=Na2SiO3 + 2H2↑
SiO2+2NaOH= Na2SiO3+H2O
3S+6NaOH  2Na2S+ Na2SO3+3H2O
2Na2S+ Na2SO3+3H2O
3.溶解油脂等有机物,可用于纺织印染、电镀等 工业.
二、 中和物质
“强碱性”是NaOH的重要性质,利用它与其他 物质的中和反应,用于科学实验、化工生产精炼石油等.
2NaOH+ H2SO4 =Na2SO4+2H2O
C17H35COOH+NaOH C17H35COONa+H2O
C17H35COONa+H2O
三、 制取物质
1.制取NH3,用铵盐和碱加热的方法制取:
(NH4)2SO4+2NaOH = Na2SO4+2NH3↑+2H2O
2.制取CH4用无水CH3COONa和碱石灰反 应:
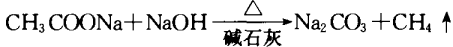
3.制肥皂,油脂在碱性条件下水解(皂化反应):
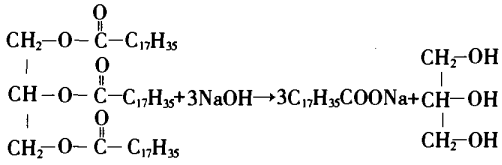
4.制取烯烃,卤代烃与强碱的醇溶液共热:
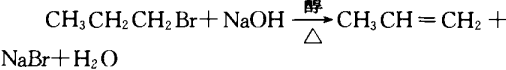
5.制取醇,卤代姪与强碱的水溶液共热:
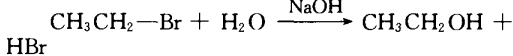
四、鉴别物质
在中学化学中常见的阳离子大多数可用NaOH 作试剂来鉴别.
1.鉴别NH3
NH4++OH- NH3↑ +H2O
NH3↑ +H2O
放出无色刺激性气性,该气体使润湿红色石蕊试 纸变蓝.
2.鉴另Al3+
Al3++3OH- =A1(OH)3↓ (加适量 NaOH 产生 白色絮状沉淀)
Al(OH)3 + OH- = AlO2- + 2H2O(加过量 NaOH沉淀溶解)
3.鉴别Fe2+
Fe2++2OH- =Fe(OH)2↓
产生白色沉淀,立即变成灰绿色最后变成红褐色:
4Fe(OH)2+2H2O+O2 =4Fe(OH)3↓
4.鉴别Fe3+
Fe3++3OH- =Fe(OH)3↓ (产生红褐色沉淀)
5.鉴别Cu2+
Cu2++2OH- =Cu(OH)2↓ (产生蓝色沉淀,加 热变成黑色)
Cu(OH)2  CuO+H2O
CuO+H2O
除了上述离子外,Ag+、Mg2+、Zn2+也可用 NaOH作试剂鉴别。
五、 吸收物质
1.NaOH易从空气中吸收水分及CO2等酸性气 体,故实验室中可做干燥剂,应密闭存放。
CO2 + 2NaOH=Na2CO3 + H2O
SO2 + 2NaOH = Na2SO3+H2O
2.实验室制取Cl2,多余Cl2用NaOH吸收,防 止污染。
Cl2+2NaOH=NaCl+NaClO+ H2O
3.工业上制取HNO3,用碱液吸收尾气,防止污 染空气。
NO+ NO2+2NaOH=2NaNO2 + H2O
六、 提取物质
利用苯酚与碱反应,可用NaOH把苯酚从煤焦油里提取岀来
C6H5OH+NaOH C6H5ONa+H2O
C6H5ONa+H2O
C6H5ONa+CO2+H2O C6H5OH+NaHCO3
C6H5OH+NaHCO3
七、与某些化合物反应,用于制备物质、科学实验及化工生产
1.与两性物质反应
Al(OH)3+NaOH=NaAlO2+2H2O
Zn(OH)2+2NaOH=Na2ZnO2+2H2O
NH2-CH2-COOH+NaOH NH2-CH2—COONa+H2O
NH2-CH2—COONa+H2O
2.与某些盐反应
CuSO4+2NaOH=Cu(OH)2↓ +Na2SO4
3.与某些有机物反应
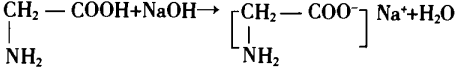
4.作反应介质
有些有机物的水解,在碱性环境下容易进行.
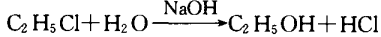
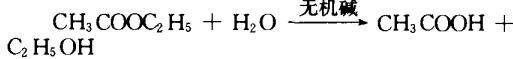
酰胺在碱性条件下水解.
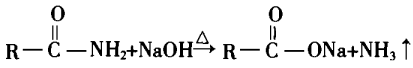

- 全部评论(0)
