守恒观解决具体的化学问题
时间:2020-03-05 19:05 来源:未知 作者:赵双燕 点击: 次 所属专题: 守恒法 化学观念
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
守恒思想在自然科学中是普遍存在的,是定量研究物质化学变化过程中的永恒主题,是学习化学的重要学科思想之一。守恒思想有多种表述形式,如物料守恒、质量守恒、元素守恒、原子守恒、离子守恒、电子守恒、电荷守恒、物质的量守恒、体积守恒等等。其实可以归结为三种守恒:一是化学反应是原子的重新组合故都存在着物料守恒:从宏观物质看即质量守恒,从微观粒子看即以物质的量为主的粒子守恒;二是氧化-还原反应中得失电子总数相等:电子守恒;三是化合物及电解质溶液中阴阳离子电荷数相等呈电中性:电荷守恒。在平时教学中不仅要注意强化守恒意识,而且还要结合守恒观认真抓住物质变化过程中某一特定量固定不变来解决化学变化的有关具体问题。
例1.向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL1mol·L-1的盐酸,恰好使混合物完全溶解,放出224mL(标准状况下)的气体。所得溶液中加入KSCN溶液无血红色出现,混合物中铁元素的质量分数为(
A.81.4%
解析:依题意知,n(HCl)=0.1mol,由于混合物与盐酸反应所得溶液中,加入KSCN溶液无血红色出现,说明反应后溶液中只有FeCl2,根据Cl-离子守恒知:n(Fe)=n(HCl)÷2=0.05mol;由于反应后盐酸中的氢元素转化为氢气和水,根据氢元素守恒知生成的H2O的物质的量为:[n(HCl)-n(H2)×2]÷2=0.04mol;根据氧元素守恒知:原混合物中氧元素的物质的量就是H2O的物质的量,等于0.04mol;故混合物中铁元素的质量为:0.05mol×56g·mol-1=2.8g,混合物的质量为:2.8g+0.04mol×16g·mol-1=3.44g;故混合物中铁元素的质量分数为:2.8/3.44=81.4%。
答案:A。
例2.(2010全国Ⅱ卷10)若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为(
解析:根据得失电子守恒知:生成1molN2时失去6mol电子,生成1molSO2时得到2mol电子,
n(N2)×6= n(SO2)×2,即生成1molN2的同时生成3mol SO2,根据硫元素守恒知参与分解反应的(NH4)2SO4为3mol,价态变化N原子为2mol,则价态未变的N原子为(3×2-2)mol=4mol;故化合价发生变化和未发生变化的N原子数之比为1∶2。或采取配平方程式法求得。3(NH4)2SO4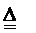 3SO2↑+ N2↑+ 4NH3↑+6H2O,观察方程式中知:化合价发生变化和未发生变化的N原子数之比为1∶2。
3SO2↑+ N2↑+ 4NH3↑+6H2O,观察方程式中知:化合价发生变化和未发生变化的N原子数之比为1∶2。
答案:B。
例3.(2009上海高考卷)根据下表提供的数据,判断在等物质的量浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是(
化学式 | |
HClO | K=3×10-8 |
H2CO3 | K1=4.3×10-7 |
K2=5.6×10-11 |
A.c(HCO3-)>c(ClO-)>c(OH-)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)
解析:由电离常数可知ClO-的水解程度大于HCO3-的水解程度,故该混合溶液中c(HCO3-)>c(ClO-) >c(OH-) >c(H+),选项A正确,选项B错误。观察选项C,等号两侧均含有同一元素,知物料守恒:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),选项C漏了c(CO32-)错误。观察选项D,等号一侧全是阳离子,另一侧全是阴离子。知电荷守恒:c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+2 c(CO32-),选项D漏了2c(CO32-)错误。
答案:A。
感悟:有关化学方程式计算、有关化学式计算等常用物料守恒、质量守恒、元素守恒、原子守恒等来列式计算;有关离子反应的计算、酸碱中和反应后混合溶液的pH计算等常用离子守恒计算;氧化还原反应方程式正确书写及有关计算、原电池和电解池的电极方程式正确书写、总反应式正确书写及有关电化学计算,均涉及到氧化还原反应,常用电子守恒;离子方程式的正确书写及有关计算、电解质溶液中离子浓度大小的比较等常用电荷守恒;由盖斯定律根据已知反应的焓变求目标反应的焓变,其本质就是利用能量守恒;利用建立等效平衡模型解答有关平衡移动问题或有关计算,其本质就是利用原子守恒。显然,守恒观是高中化学常用且重要的解题思想方法之一,要根据不同的守恒思想,快速建立恒等式关系,巧妙作答,可以提高解题速率和准确率。
训练:1.(2011广东高考卷11)对于0.1 mol·L-1Na2SO3溶液,正确的是(
A.升高温度,溶液的pH降低
B.c(Na+)=2c(SO32-)+ c(HSO3-)+ c(H2SO3)
C.c(Na+)+c(H+)=2c(SO32-)+ 2c(HSO3-)+c(OH-)
D.加入少量NaOH固体,c(SO32-)与c(Na+)均增大
提示:Na2SO3属于强碱弱酸盐水解显碱性:SO32-+H2O HSO3-+OH-、HSO3-+H2O
HSO3-+OH-、HSO3-+H2O H2SO3+OH-,因为水解是吸热的,所以升高温度,有利于水解,碱性会增强,选项A不正确;加入少量NaOH固体,c(OH-)增大,抑制水解,所以c(SO32-)增大,选项D正确;由物料守恒知钠原子个数是硫原子的2倍,因此有c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3),所以选项B不正确,由电荷守恒知c(Na+)+ c(H+)=2c(SO32-)+ c(HSO3-)+c(OH-),因此选项C也不正确。
H2SO3+OH-,因为水解是吸热的,所以升高温度,有利于水解,碱性会增强,选项A不正确;加入少量NaOH固体,c(OH-)增大,抑制水解,所以c(SO32-)增大,选项D正确;由物料守恒知钠原子个数是硫原子的2倍,因此有c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3),所以选项B不正确,由电荷守恒知c(Na+)+ c(H+)=2c(SO32-)+ c(HSO3-)+c(OH-),因此选项C也不正确。
答案:D。
2.(2011全国Ⅱ卷13)某含铬Cr2O72-废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是(
A.消耗硫酸亚铁铵的物质的量为n(2-x)mol
B.处理废水中Cr2O72-的物质的量为nx/2mol
C.反应中发生转移的电子的物质的量为3nx mol
D.在FeO·FeyCrxO3中3x=y
提示:由铬元素守恒知废水中Cr2O72-的物质的量为nx/2mol,反应中发生转移的电子的物质的量为nx/2mol×6=3nx mol;由得失电子守恒知:ny×1=3nx,即y=3x。由铁元素守恒知消耗硫酸亚铁铵的物质的量为n×(1+y)mol=n(1+3x)mol,因此选项A是错误的。
答案:A。
3.(2011上海高考卷30有删减)氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。根据题意完成下列计算:
该氢化物受撞击则完全分解为氮气和氢气。4.30g该氢化物受撞击后产生的气体在标准状况下的体积为___________L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0kg水,计算推进剂中联氨的质量。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为NO+ 4NH3=5N2+6H2O
提示:(1)利用氢化物的相对分子质量直接求出组成该氢化物两种元素的原子数,而后求得分子式。N原子数=43.0×0.977÷14=3,H原子数=43.0×0.023÷1=1,故分子式为HN3。因为该氢化物分解生成两种气体都是双原子分子,根据N原子、H原子守恒可求得混合气体体积。
4.30gHN3为0.1mol,氮气和氢气混合气体积为0.1mol×4÷2×22.4L·mol -1=4.48L。
(2)依题意知N2H4被氧化生成H2O,根据氢元素守恒可求得N2H4质量。
(3)根据N原子守恒可求得参加反应的氨的物质的量。n(NH3)+180mol=156mol×2,n(NH3)=132mol。
根据氧化还原反应中得失电子守恒可求得NO与NO2的物质的量。
设为NO的物质的量X,NO2的物质的量为(180mol-X),
132mol×3=Xmol×2+(180-X)mol×4,X=162mol,(180mol-X)=18mol,
NO与NO2体积比为162∶18=9∶1。
根据质量守恒可求得反应后溶液质量。
8.90×103g+162mol×30g·mol-1+18mol×46gmol-1-156mol×28g·mol-1=10220g,其溶液体积为10220g÷0.980g·cm-3=10428cm3=10428mL=10.428L,反应后溶液中剩余溶质氨的物质的量是8.90×103g×0.300÷17g·mol-1-132mol=25.058mol,吸收后氨水的物质的量浓度为25.058mol÷10.428L=2.4 mol·L-1。
答案:(1)HN3

- 全部评论(0)
