晶体结构疑难问题集
时间:2016-01-30 15:07 来源:未知 作者:李文才 点击:次 所属专题: 晶体结构
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
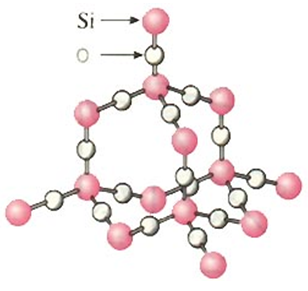
例题、二氧化硅是立体的网状结构,其晶体模型如图所示,请认真观察该晶体模型后回答以下问题:
(1)二氧化硅晶体中最小环为
(2)每个硅原子为
(3)每个最小环平均拥有
解答:
(1)SiO2晶体中Si原子的排列方式和金刚石晶体中碳原子的排列方式是相同的。在金刚石晶体中,每个最小环上有6个碳原子,因此SiO2晶体中每个最小环上有6个Si原子,另外六边形的每条边上都夹入了一个氧原子,所以最小环为12元环。
(2)如图可以看出,每个硅原子周围有四条边,而每条边又被6个环所共有,同时由于每个环上有两条边是同一个硅原子周围的,因此还要除以2以剔除重复。所以最终计算式为(4×6)/2=12
(3)由于每个硅原子被12个环共有,因此每个环只占有该硅原子的1/12,又因为每个最小环上有6个硅原子,所以每个最小环平均拥有的硅原子数为:6×(1/12)=0.5个。又因为SiO2晶体是由硅原子和氧原子按1:2的比例所组成,因此氧原子的数目为0.5×2=1个。
(4)1molSiO2中含有多少Si-O键?
图最中间的那个Si原子,与之相连的有4个O原子。事实上,并不是全部属于这1个Si原子的,而是与另外一个共有的。所以,你把这4个O原子假设都劈成一半,那么,这就是一个最小意义上的结构了。也就是,一个Si原子和4个的半个O原子,可以数一下有4根。将这个重复单元乘一下Na,就是1mol SiO2,含有4mol 的Si-O键
请关注以下小结:
【关于二氧化硅】
(1)为正四面体型结构
(2)每个硅连4个氧原子,
(3)最小环为12元环,其中有
(4)一个硅原子被12个环共有
(5)硅原子与Si-O键数比是
【关于金刚石】
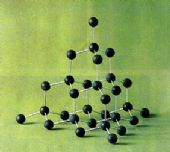
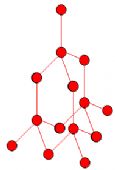
(1)与 4个碳相连,呈空间正四面体形;
(2)6个碳原子形成一个环;
(3)一个碳被12个环共有;
(4)碳原子与键数比是( 1:2 );即每摩尔(12克)金刚石含C-C键 2
【关于石墨的晶体】每个碳原子与三个碳原子以共价键形成平面正六边形,无限延伸。。。,而层与层间有自由电子,层之间作用力为范德华力。层之间能滑动。
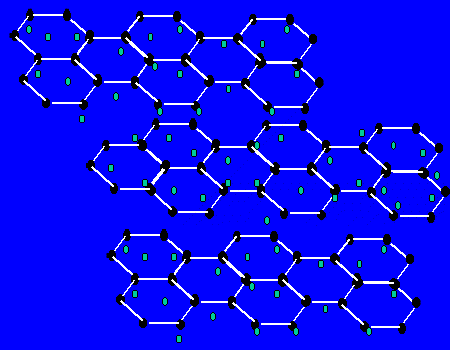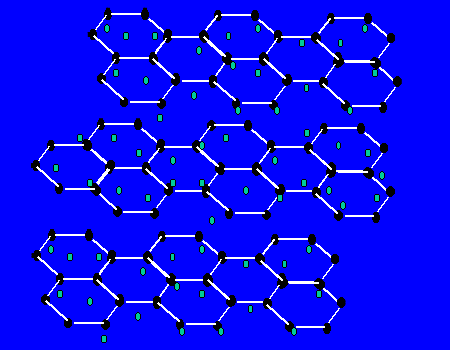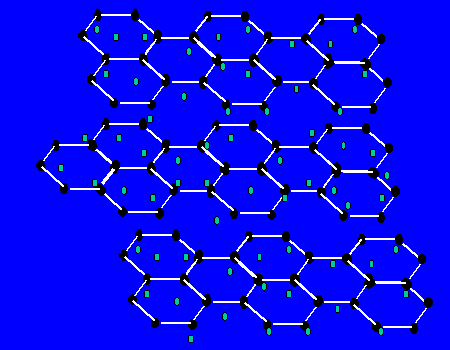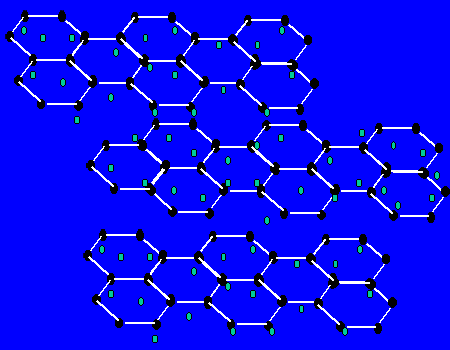
(1)最小环有6个C原子
(2)每个C原子为3个环共有;
(3)C原子和C-C键之比为2:3
【关于C60分子】
例题、1996年诺贝尔化学奖授予对发现C60有重大贡献的三位科学家。
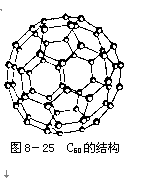
C60分子是形如球状的多面体(如图8-25),该结构的建立基于以下考虑:
①C60分子中每个碳原子只跟相邻的3个原子形成化学键;
②C60分子中只有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数=2。
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30。请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是
(2)试估计C60与F2在一定条件下,能否发生反应生成C60f60(填“可能”或“不可能”)
(3)通过计算确定C60分子所含单键数。C60分子所含单键数为
(4)C70分子也已制得,它的分子结构模型可以与C60同样考虑而推知。通过计算确定C70分子中五边形和六边形数目。C70分子所含五边形数为


- 全部评论(0)
