电化学规律
时间:2016-02-04 13:04 来源: 作者:李文才 点击: 次 所属专题: 电化学
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、正负极的多角度理解
负极:较活泼的金属;发生氧化反应的一极;电子丰富的一极;电子流出的一极;电流流入的一极;被腐蚀的一极。
正极:较不活泼的金属;发生还原反应的一极;电子贫乏的一极;电子流入的一极;电流流出的一极;被保护的一极。
例1:国外新近研制的溴—锌蓄电池的基本构造是用碳棒作两极,溴化锌溶液作电解液,现有四个电极反应:
① Zn-2e-=Zn2+② Zn2++2e-=Zn
③ Br2+2e-=2Br- ④ 2Br--2e-=Br2
那么充电时的阳极和放电时的负极的反应分别是 (A)
A. ④① B. ②③ C. ③① D. ②④
解析:电解池的阳极和原电池的负极都是氧化极,即发生失电子的氧化反应,故应选A。
例2:下列关于铜电极的叙述正确的是(MCe98·10) ( AC )
A. 铜锌原电池中铜是正极 B. 用电解法精炼粗铜时粗铜作阴极
C. 在镀件上电镀铜时可用金属铜作阳极 D. 电解稀硫酸制H2、O2时铜作阳极
解析:电解精炼铜是纯铜作阴极,粗铜作阳极;电解稀硫酸时用惰性电极时才能是电解水得到H2、O2,若用铜作阳极,则铜电极会反应的。
例3:某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是 (上海02.16) (B)

A. a为正极,b为负极;NaClO和NaCl
B. a为负极,b为正极;NaClO和NaCl
C. a为阳极,b为阴极;HClO和NaCl
D. a为阴极,b为阳极;HClO和NaCl
解析:电解氯化钠溶液产生氢气和氯气,以及氢氧化钠溶液,由于氯气与氢氧化钠溶液反应了,只有氢气放出;而氢气是在阴极区产生的,故a极所连接的电极应是阴极,a就为负极。由于氯气与氢氧化钠反应生成NaClO和NaCl,故应选B。
2、电解保浓
规律:(1) 电镀本身是保浓的,不需外加物质。
(2) 电解消耗什么就加什么,如果是两种物质,则将两种物质合起来。
例4:用铂作电极电解一定浓度的下列物质的水溶液。电解结束后,向剩余电解液中加适量水,能使溶液和电解前相同的是(MCe88·15) ( CD )
A. NaCl B. AgNO3 C. H2SO4 D. NaOH
解析:电解后加水才能保浓,则这种电解类型为电解水,H2SO4和NaOH溶液的电解属于这种类型。而NaCl溶液和AgNO3溶液的电解是混合电解。
例5:用铂电极电解一份硝酸银溶液一段时间后,为恢复该溶液的成分、浓度及酸碱性,应加入适量的 (A)
A. 氧化银 B. 氢氧化银 C. 硝酸银 D. 氨水
解析:使用惰性电极时,硝酸银溶液的电解是混合电解,电解的化学方程式如下:4AgNO3+2H2O 4Ag+4HNO3+O2,而4Ag+O2=2Ag2O
4Ag+4HNO3+O2,而4Ag+O2=2Ag2O
故应选A。
3、金属被腐蚀或被保护的比较
规律:(1) 电解池的阳极腐蚀最快,其次是原电池的负极,再次为自然腐蚀。
(2) 电解池的阴极保护是好,其次是原电池的正极,再次为一般保护。
例6:下列各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 (A)
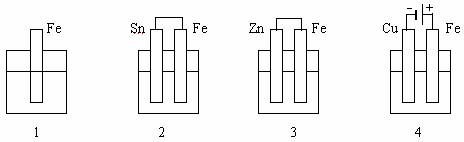
A. 4>2>1>3 B. 2>1>3>4 C. 4>2>3>1 D. 3>2>4>1
解析:4中Fe为电解池的阳极,腐蚀最快;3中Fe为原电池的正极,被保护得最好;3中Fe为原电池的负极,被腐蚀得较快。
4、腐蚀的电极和被保护的电极
常温下,惰性电极不参加反应。原电池中的负极材料被腐蚀,正极材料被保护。电解池中的阳极材料被腐蚀,阴极材料被保护。
例如,外加电流的阴极保护法,是把要保护的钢铁设备作为阴极,另外用不溶性电极作为辅助阳极;两者都放在电解质溶液里,接上外加直流电源。又如牺牲阳极的阴极保护法,在要保护的钢铁设备(如钢闸门)上联结一种更易失去电子的金属或合金。前者的原理是电解原理,后者的原理是原电池原理。
5.比较金属的活泼性或还原性
规律:(1) 原电池中,作为负极材料的金属的活泼性大于作为正极材料的金属。
(2) 电解池中,在阳极上先被溶解的金属活泼,在阴极上最先析出的金属最不活泼。
例7:有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等浓度的盐酸中,D比A反应剧烈。用石墨电极电解同浓度B、C硝酸盐的混合溶液时,C比B先在阴极析出。则四种金属的活动性顺序由强到弱的是 (A)
A. D > A > B > C B. A > B > C > D
C. C > B > A> D D. C > D > A> B
解析:A与B构成的原电池中,A为负极,B为正极,说明A比B活泼;A、D与盐酸的反应中显示D比A活泼;用石墨电极电解B、C硝酸盐的混合溶液时的现象说明B比C活泼。
6.电池、电解池的特点
原电池:一边下,一边上,电子就在中间转。
一类原电池:正极材料不参与反应。
二类原电池:大多发生正极上的吸氧腐蚀反应。
可逆电池:两极材料皆要发生变化。
一般电解:阳极放电:无氯有氧;阴极放电:前氢后金。(氢前析氢,氢后析金。)
三类:电解电解质(自杀);电解水(死里逃生);混合电解(全军覆没)。
特殊电解:两极分化严重,阳极越来越瘦,阴极越来越胖。
两类:电镀(包子);电解精炼(镘头)。
电镀池:电解保浓。一边下,一边上,电解质浓度不变样。
电解精炼池:一边下,一边上,电解质浓度要变样。
例8:从H+、Na+、Ba2+、Cu2+、Cl-、SO42-中选出两种离子组成电解质,按下列要求进行电解,将电解质的化学式填空:(使用惰性电极)
(1) 电解过程中溶液颜色变浅且水量不变_______________________;
(2) 电解过程中电解质含量不变,水量减少_______________________;
(3) 电解过程中溶液的pH值减小_______________________;
(4) 电解过程中,两极析出气体的体积比为1∶1_______________________;
解析:(1) 水量不变,说明是电解质被电解,而颜色变浅则说明是CuCl2被电解。
(2) 此为电解水,应该是含氧酸或活泼金属的含氧酸盐溶液才行。
(3) 此应为电解后产生酸,如CuSO4;另外,含氧酸溶液中水被电解,酸浓度增大,pH值也减小;特殊的是CuCl2溶液电解产生的Cl2溶于水而使溶液酸性增强。
(4) 电解产生H2和Cl2。
答案:(1)CuCl2 (2) Na2SO4、H2SO4 (3) H2SO4、CuSO4、CuCl2 (4) HCl、NaCl、BaCl2
例9:按右图装置实验,A、b两烧杯分别盛放200 g 10%NaOH溶液和足量CuSO4溶液。通电一段时间后,C极上有Cu析出。又测得a杯溶液中NaOH的质量分数为10.23%,试回答:
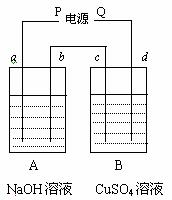
(1) 电源P为________极;
(2) b极产生气体的体积为_______L(标准状况);
(3) C极上析出沉淀的质量为__________G;
(4) D极上所发生的电极反应式:______________。
解析:B池中C极上有金属析出,说明它为阴极。
由此可知, d、b为阳极,a为阴极。按照“正接阳,负接阴”的规律,电源P为负极。
NaOH溶液电解为电解水,a极产生H2,b极产生O2;CuSO4溶液的电解为混合电解,D极产生O2,其电极反应式为:4OH--4e-=2H2O+O2↑。
m(NaOH)=200 g×10%=20 g
电解后溶液的质量为: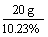 =195.5 g
=195.5 g
被电解的水为:200 g-195.5 g=4.5 g,为0.125 mol。
由此可知,b极产生的O2为0.125 mol,即2.8 L。
根据总价数相等关系,O2的总价数等于Cu的总价数,可得:
0.125 mol×4n(Cu)×2n(Cu)=0.25 mol,即16 g。
答案:(1) 负 (2) 2.8 (3) 16 (4) 4OH--4e-=2H2O+O2↑

- 全部评论(0)
