晶体结构的有关计算
时间:2016-01-30 14:50 来源:未知 作者:黄勇 点击:次 所属专题: 晶体结构计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
中学课本中列举了NaCl、CsCl、金刚石、石墨、干冰、二氧化硅等典型晶体的结构示意图。它们的结构都是立体的,如何从平面图想像出三维实物的结构形态,这是解决有关问题的关键。
首先可以利用直观结构模型,逐步建立起准确、清晰的立体形象,提高空间想像力。
? 其次还需掌握基本的解题技巧:在晶体结构中切割一个基本结构单元,弄清该单元中点、边、面为多少个基本结构单元所共有,则这一个点、一条边、一个面对一个基本结构单元的贡献只能是它的10/n(n为共有的基本结构单元数)。
中学阶段所需掌握的几种晶体类型及有关问题:
一、NaCl型(如图1)
1.在晶体中,每个Na+同时吸引6个Cl-,每个Cl-同时吸引着6个Na+,阴、阳离子数目之比是1∶1。
2.在晶体结构中,每个基本结构单元(小立方体)的8个顶点分别由4个Na+、4个Cl-相邻占据,每个小立方体含Na+:(1/8)×4=(1/2)个、含Cl-:(1/8)×4=(1/2)个。每个晶胞由8个小立方体构成,故每个晶胞有NaCl微粒8×(1/2)=4个。
3.在晶体中,经过立方体的中心Na+的平面有三个,每个平面的四个顶点上的Na+都同晶体中与中心Na+最接近且距离相等。所以,在晶体中,每个Na+周围与它最接近的距离相等的Na+的个数共有12个。同理,每个Cl-周围与它最接近且距离相等的Cl-的个数也有12个。
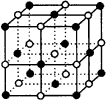 | 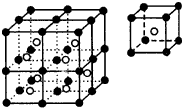 |
| 图1 NaCl晶体 | 图2 CsCl晶体 |
二、CsCl型(如图2)
1.在晶体中,每个Cl-吸引8个Cs+,每个Cs+吸引8个Cl-,Cs+与Cl-的个数比为1∶1。
2.每个基本结构单元中(小立方体)含Cl-:(1/8)×8=1个,含Cs+1个。
3.在晶体中,若以一个Cs+为原点作三维空间坐标系,以相邻最接近的Cs+间的距离为半径作球面与坐标系共有6个交点。所以,每个Cs+周围与它最接近且距离相等的Cs+的个数共有6个。同理,每个Cl-周围与它最接近的且距离相等的Cl-共有6个。
三、干冰型(如图3)
以晶型小立方体一个顶点为中心,相邻的三棱两两为边作截面(三个),根据晶体是由多个晶胞累积扩展的原则,可想像出来表示在晶胞图上与一个CO2分子相邻且等距离的CO2分子共有12个。
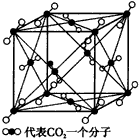 |
| 图3 干冰晶体 |
四、正四面体型
(金刚石、硅、二氧化硅)(如图4、图5)
1.金刚石晶体中,每个碳原子与4个相邻的碳原子形成4个C—C键。
2.在金刚石晶体中,由于一个碳原子所形成的4个键共有C?4?2=6种两两相邻的组合,每个键可形成两个近似垂直的六元环,故每个碳原子最多可形成6×2=12个六元环,一个六元环实际拥有6×(1/12)=(1/2)个碳原子。
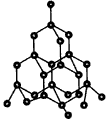 | 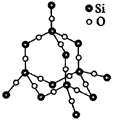 |
| 图4 金刚石晶体 | 图5 SiO2晶体 |
3.在金刚石晶体中,固定一个C—C键,其余三键与该键有C?3?1=3种两两相邻的组合,故一个C—C最多可形成3×2=6个六元环,每个六元环拥有6×(1/6)=1个C—C键。
4.硅晶体结构与金刚石晶体结构相同。
5.由上述推导过程可知:在二氧化硅晶体中,最小环为12元环(6个硅原子和6个氧原子),每个12元环实际拥有6×(1/12)=(1/2)个硅原子,拥有(1/6)×6=1个氧原子,故硅、氧原子个数比为1∶2。
五、石墨型(如图6)
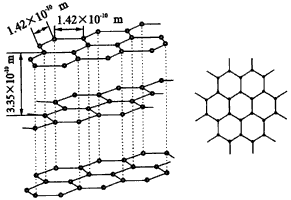 |
| 图6 石墨晶体 |
1.石墨晶体为层状结构。每一层中碳原子排列成六边形,一个个六边形(六元环)排列成平面的网状结构,键角120°。
2.每一个碳原子都跟相邻的碳原子以共价键相结合。因此,每个六元环拥有碳原子(1/3)×6=2个,每个环拥有C—C键(1/2)×6=3个。
3.mg石墨中,正六边形数目为(m/12)NA÷2=(mNA/24)。

- 全部评论(0)
