碱金属中的一般与特殊
时间:2016-01-18 10:18 来源:未知 作者:欧阳文兵 点击: 次 所属专题: 碱金属
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
兹将《碱金属》中的一般与特殊小结如下:(括号内为反例)
1.常温下碱金属很容易被空气里氧气所氧化。也易与水蒸气反应,故所有的碱金属都必须保存在煤油中,以隔绝空气和水。(Li的密度小于煤油,故不能保存在煤油中,而必须保存在密度更小的石蜡油中或密封于石蜡中。)
2.在碱金属中,随原子序数的增加,其密度一定增大。(K的密度0.862g/cm3反比钠0.971g/cm3小。出现这一反常现象的原因是由于从钠到钾相对原子质量增大所起的作用小于原子体积增大所起的作用。)
3.酸不稳定,它所对应的盐一般也不稳定。(H2CO3不稳定,但Na2CO3却稳定。)
4.酸式盐的水溶液一般显酸性。(NaHCO3的水溶液却显碱性。)
5.酸式盐的溶解度一般大于正盐。(NaHCO3的溶解度反比Na2CO3小。)
6.碱金属与足量氧气反应,都能生成过氧化物或超氧化物。(Li与O2反应,只能生成正常氧化物Li2O,且熔点高,在水中溶解度较小。)
7.碱金属元素在化合物中只能显+1价。(Li在一定条件下,三个电子都能失去,故有+3价,如Li2O3。)
8.氧在任何情况下都显-2价,氢在任何情况下都显+1价。(Na2O2,H2O2中氧显-1价;NaH,CaH2中氢显-1价)。
9.所有的碱溶液都能使酚酞变红。(浓NaOH溶液遇酚酞不变色。)
10.盐的水溶液不可能有强酸性。(NaHSO4具有强酸性,它能与活泼金属反应产生H2。)
11.所有的钾盐、钠盐都易溶于水。(KClO4微溶于水,Na2SiF6难溶于水。)
12.电子层数越多,微粒半径就越大。(Al3+有两个电子层,Li+只有一个电子层,但γLi+>γAl3+。)
13.只要涉及到“反应”二字,通常就一定发生了化学变化。(焰色反应却属于物理变化。)
14.试剂瓶中药品取出后,一律不允许放回原试剂瓶。(取用后剩余的Na,K等反应立即放回原瓶。)
15.一定是活泼金属置换不活泼金属。
(Na+KCl![]() NaCl+K;对于Na,K等活泼金属,将其放入CuSO4溶液中将得不到金属铜。将Na与CuSO4溶液反应,其反应式如下:2Na+2H2O===2NaOH+H2↑;2NaOH+CuSO4===Cu(OH)2↓+Na2SO4,总反应式为:2Na+CuSO4+2H2O===Cu(OH)2↓+H2↑+Na2SO4。)
NaCl+K;对于Na,K等活泼金属,将其放入CuSO4溶液中将得不到金属铜。将Na与CuSO4溶液反应,其反应式如下:2Na+2H2O===2NaOH+H2↑;2NaOH+CuSO4===Cu(OH)2↓+Na2SO4,总反应式为:2Na+CuSO4+2H2O===Cu(OH)2↓+H2↑+Na2SO4。)
16.同一主族元素,从上到下,其熔沸点一定递增。(碱金属从Li→Cs,其熔沸点递减。这是因为碱金属是金属晶体,晶体中存在的是金属键,从Li→Cs,最外层电子数相同,原子半径依次增大,金属键依次减弱,故从Li→Cs,熔沸点依次降低。)
17.金属性强的元素,其金属活动性也一定强。(Na的金属性比Ca强,但Ca的金属活动性却比Na大。这是因为金属性通常指的是金属原子失去电子的性质;而金属活动性指的是金属单质在水溶液中形成水合离子倾向的大小。由于Na失去电子能力大于Ca,因此Na的金属性比Ca强;但Ca在水溶液中形成水合离子的倾向比Na大,故Ca的金属活动性比Na大。)
18.碱金属单质与水反应都很快。(Li与H2O反应却比较慢。这是因为产物LiOH溶解度较小,覆盖在Li表面,阻止了反应的进行;再则Li的熔点较高,反应时锂块不如钠球与水接触面积大之故。)
19.碱金属的氢氧化物都是强碱,且不易分解。(LiOH却属于中强碱,且溶解度较小)
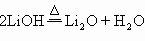
20.以M代表碱金属元素,其硝酸盐分解时一般按下式进行:
![]()
![]()

- 全部评论(0)
